
 NH4++NH2- �ݴ��ж����������д������ �� ��
NH4++NH2- �ݴ��ж����������д������ �� ��| A��Һ���к���NH3��NH4+��NH2-���� |
| B��һ���¶���Һ����C(NH4+)��C(NH2-)��һ������ |
| C��Һ���ĵ���ﵽƽ��ʱC(NH3) = C(NH4+) = C(NH2-) |
| D��ֻҪ�������������ʣ�Һ����C(NH4+) = C(NH2-) |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������10 |
| B������10 |
| C����10 |
| D�����ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1.0��10��7 mol��L��1 | B��1.0��10��6 mol��L��1 |
| C��1.0��10��2 mol��L��1 | D��1.0��10��12 mol��L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH��7 | B��C��A-����c��B+�� |
C��C��OH-����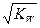 | D��C��H+��- C��OH-����C (A-)- C��B+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2XY3(g) ��H����92.6 kJ��mol��1
2XY3(g) ��H����92.6 kJ��mol��1| ���� ��� | ��ʼʱ���������ʵ���/mol | ��ƽ��ʱ��ϵ�����ı仯 | ||
| X2 | Y2 | XY3 | ||
| �� | 1 | 3 | 0 | ���� 23.15 kJ |
| �� | 0.6 | 1.8 | 0.8 | Q(Q��0) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������HΪ��һ��ʱ����ʾ�÷�ӦΪ���ȷ�Ӧ |
B����֪C(s)+ O2(g) O2(g) CO(g)�ķ�Ӧ��Ϊl10.5kJ��mol��˵��̼��ȼ����Ϊ110.5kJ��mol CO(g)�ķ�Ӧ��Ϊl10.5kJ��mol��˵��̼��ȼ����Ϊ110.5kJ��mol |
| C����Ӧ�ȵĴ�Сȡ���ڷ�Ӧ��������������������������������������Դ�С |
| D����Ӧ�Ȳ����뷴Ӧ��ϵ��ʼ̬���յ�״̬�йأ������뷴Ӧ��;��Ҳ�й� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com