
 2XY3(g) ��H����92.6 kJ��mol��1
2XY3(g) ��H����92.6 kJ��mol��1| ���� ��� | ��ʼʱ���������ʵ���/mol | ��ƽ��ʱ��ϵ�����ı仯 | ||
| X2 | Y2 | XY3 | ||
| �� | 1 | 3 | 0 | ���� 23.15 kJ |
| �� | 0.6 | 1.8 | 0.8 | Q(Q��0) |
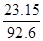 ��2mol=0.5mol����c(XY3)=
��2mol=0.5mol����c(XY3)=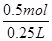 =2 mol��L-1����ȷ��D�������������Ϊ0.20 L���൱��ԭ��Ӧ��С�������ѹ��ƽ�������ƶ����ʷų�����������23.15 kJ����ȷ��
=2 mol��L-1����ȷ��D�������������Ϊ0.20 L���൱��ԭ��Ӧ��С�������ѹ��ƽ�������ƶ����ʷų�����������23.15 kJ����ȷ��

 ��ɢ˼ά�¿���ϵ�д�
��ɢ˼ά�¿���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1.8��10-13����10-13mol��L |
| B��1.8��10-12����10-12mol��L |
| C��1.5��10-13����10-13mol��L |
| D��1.8��10-13����10-12mol��L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 NH4++NH2- �ݴ��ж����������д������ �� ��
NH4++NH2- �ݴ��ж����������д������ �� ��| A��Һ���к���NH3��NH4+��NH2-���� |
| B��һ���¶���Һ����C(NH4+)��C(NH2-)��һ������ |
| C��Һ���ĵ���ﵽƽ��ʱC(NH3) = C(NH4+) = C(NH2-) |
| D��ֻҪ�������������ʣ�Һ����C(NH4+) = C(NH2-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ۢ� | B���ڢ� | C���٢ܢ� | D���ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���кͷ�Ӧ�����ȷ�Ӧ |
| B��ȼ���Ƿ��ȷ�Ӧ |
| C����ѧ�����ѷų����� |
| D����Ӧ����������������������һ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����H1>��H2>��H3 | B����H1<��H2<��H3 | C����H1����H2<��H3 | D����H1<��H2����H3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| �� �� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1 mol NO2 1 mol CO | 2 mol NO 2 mol CO2 | 1 mol NO2��1 mol CO 1 mol NO��1 mol CO2 |
| ƽ��ʱc(NO) /mol��L-1 | 1.5 | 3 | m |
| �����仯 | �ų�a kJ | ����b kJ | �ų�c kJ |
| CO��NO��ת���� | ��1 | ��2 | ��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com