
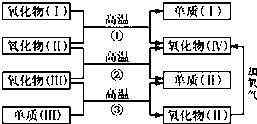
 一些氧化物和单质之间可发生如图所示的反应:
一些氧化物和单质之间可发生如图所示的反应:分析 氧化物(Ⅰ)是红棕色固体,故氧化物(Ⅰ)是Fe2O3,由于氧化物(Ⅱ)是气体,故为CO,则单质(I)是Fe,氧化物(IV)是CO2;氧化物(Ⅲ)在高温条件下为气体,则为H2O,故单质(Ⅱ)为H2;由于氧化物(Ⅲ)即CO和单质(Ⅲ)在高温条件下生成H2和CO,故单质(Ⅲ)为C,据此解答.
解答 解:氧化物(Ⅰ)是红棕色固体,故氧化物(Ⅰ)是Fe2O3,由于氧化物(Ⅱ)是气体,故为CO,则单质(I)是Fe,氧化物(IV)是CO2;氧化物(Ⅲ)在高温条件下为气体,则为H2O,故单质(Ⅱ)为H2;由于氧化物(Ⅲ)即CO和单质(Ⅲ)在高温条件下生成H2和CO,故单质(Ⅲ)为C.
(1)氧化物(Ⅰ)的化学式是Fe2O3,氧化物(Ⅱ)的化学式是CO,故答案为:Fe2O3,CO;
(2)反应①是Fe2O3与CO在高温条件下发生氧化还原反应生成Fe和CO2,化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
反应②是CO和H2O在高温条件下生成CO2和H2,化学方程式为:CO+H2O$\frac{\underline{\;高温\;}}{\;}$CO2+H2,
故答案为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;CO+H2O$\frac{\underline{\;高温\;}}{\;}$CO2+H2.
点评 本题考查考查无机物推断,氧化物(Ⅰ)是红棕色固体是本题的突破口,难度不大,熟练掌握常见元素单质化合物性质.


科目:高中化学 来源: 题型:选择题
| A. | H2燃烧热为285.8 kJ•mol-1,则2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| B. | 若C(石墨,s)=C(金刚石,s)△H>0,则石墨比金刚石稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,则0.5mol NaOH固体与稀盐酸完全中和,放出28.7kJ的热量 | |
| D. | 已知2SO2(g)+O2(g)?2SO2 (g)△H=-196.64 kJ•mol-1,在一定温度下,向一固定体积的密闭容器中通入2mol SO2、1mol O2,达到平衡时放出热量小于196.64 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
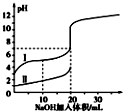 室温下,用 0.100mol/L NaOH 溶液分别与 20.00mL 0.100mol/L 的盐酸和醋酸反应,pH 与滴入碱的体积关系如图所示. 已知醋酸电离常数 K=1.7×10 -5下列说法正确的是( )
室温下,用 0.100mol/L NaOH 溶液分别与 20.00mL 0.100mol/L 的盐酸和醋酸反应,pH 与滴入碱的体积关系如图所示. 已知醋酸电离常数 K=1.7×10 -5下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的反应曲线 | |
| B. | pH=7 时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=170 | |
| C. | V(NaOH)=10.00 mL 时,醋酸溶液的导电性更强 | |
| D. | 向盐酸中加 NaOH 至 pH=12 时,V(NaOH)=200/9 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ②
② ③
③ ④TNT
④TNT查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂的作用 | B. | 还原剂的作用 | C. | 催化剂的作用 | D. | 吸附剂的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al→[Al(OH)4]- | B. | Na2CO3→NaOH | C. | Al2O3→Al(OH)3 | D. | Fe(OH)2→Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4NH3+6NO→5N2+6H2O | B. | 2NH3+3CuO→3Cu+N2+3H2O | ||
| C. | 2Na+2NH3→2NaNH2+H2↑ | D. | 4NH3+3O2→4N2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始时V正增大,V逆减小,最终SO3的百分含量增加 | |
| B. | 开始时V正增大,V逆不变,最终SO3的百分含量不变 | |
| C. | 开始时V正增大,V逆增大,最终SO3的百分含量无法判断 | |
| D. | 开始时V正增大,V逆减小,最终SO3的百分含量保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用电解熔融CeO2制取金属铈,铈在阳极生成 | |
| B. | 58138Ce、58142Ce是同素异形体 | |
| C. | 铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+═Ce4++2H2 | |
| D. | 铈的原子核外有58个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com