
| A、卤代烃 | B、醋酸 |
| C、邻二甲苯 | D、苯酚 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、常温常压下,32gO3含氧原子数为2NA |
| B、0.5LCaCl2溶液中含有Ca2+数为0.5NA |
| C、0.1mol/LMgCl2溶液中含Cl-数为0.2NA |
| D、1molH的质量与NA个氢气分子的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述不正确的是( )
某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述不正确的是( )A、断开K2,闭合K1时,总反应的离子方程式为:2H2O+2Cl-
| ||||
| B、断开K2,闭合K1时,铜电极产生的气体略多于石墨 | ||||
| C、断开K1,闭合K2时,铜电极上的电极反应为:H2-2e-=2 H+ | ||||
| D、断开K1,闭合K2时,溶液中的Na+向石墨电极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
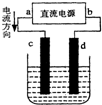 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )| A、a为负极、d为阳极 |
| B、将淀粉KI试纸的玻璃棒靠近d处一段时间会变蓝色 |
| C、电解过程中转移0.2mol电子,d电极质量增加6.4克 |
| D、电解过程中,铜离子向C极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域.
由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域.
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com