
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示,遇水易水解,并产生能使品红褪色的气体,S2Br2与S2Cl2结构相似。下列说法错误的是( )
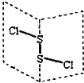
A.S2Cl2中硫原子轨道杂化类型为sp3杂化
B.S2Cl2为含有极性键和非极性键的非极性分子
C.熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为2S2Cl2+2H2O=SO2↑+3S↓+4HCl
科目:高中化学 来源: 题型:
【题目】(1)实验室制乙烯时使用了浓硫酸,它的作用是_____剂和_____剂。
(2)下列仪器装置图中(图1),可用于实验室制取乙烯的是______。
(3)有人设计下列实验(图2)以确定上述所制乙烯气体中是否混入二氧化碳。如果从瓶Ⅰ进入的乙烯中确实混有二氧化硫这种杂质,四个瓶子中可能观察到的颜色变化有_____。
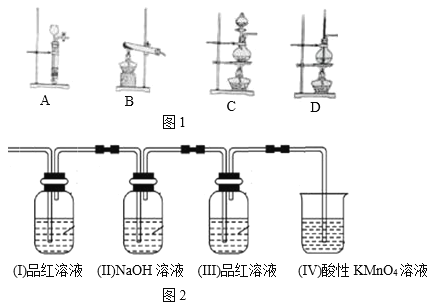
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05mg·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:
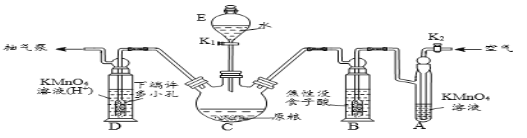
(操作流程)安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。
(实验装置)C中盛100 g原粮,D中盛有 20.00 mL 1.12×10-4 mol L-1KMnO4溶(H2SO4酸化)。
(1)仪器C的名称是_________;原粮最好先打成粉末,其原因是_____________。
(2)磷化钙与水反应化学方程式为_____________________________________;检查整套装置气密性良好的方法是_______________________________________。
(3)A中盛装KMnO4溶液的作用是除去空气中的还原性气体;B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的O2,防止___________;通入空气的作用是____________。
(4)D中PH3被氧化成磷酸,所发生反应的离子方程式为_________________________。
(5)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5mol L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,写出该反应的离子方程式________________,消耗标Na2SO3准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为______mg kg-1。
(6)滴定结束的现象_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较中,不正确的是
A. 硬度由大到小:金刚石>碳化硅>晶体硅
B. 晶格能:NaBr<NaCl<MgO
C. 键的极性:N-H<O-H<F-H
D. 熔点:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向 20 mL 0.1 mol·L-1(NH4)2SO4 溶液中逐滴加入 0.2 mol·L-1NaOH 溶液时,溶液的 pH与所加 NaOH 溶液体积的关系如图所示(不考虑挥发)。下列说法正确的是
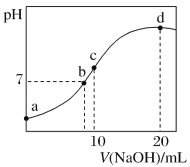
A.点 a 所示溶液中:c(NH![]() )>c(SO
)>c(SO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.点 b 所示溶液中:c(NH![]() )=c(Na+)>c(H+)=c(OH)
)=c(Na+)>c(H+)=c(OH)
C.点 c 所示溶液中:c(SO![]() )+c(H+)=c(NH3·H2O)+c(OH)
)+c(H+)=c(NH3·H2O)+c(OH)
D.点 d 所示溶液中:c(SO![]() )>c(NH3·H2O)>c(OH-)>c(NH
)>c(NH3·H2O)>c(OH-)>c(NH![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH![]() 、Cl-、Mg2+、Ba2+、CO
、Cl-、Mg2+、Ba2+、CO![]() 、SO
、SO![]() ,现取三份 100 mL 溶液进行如下实验:
,现取三份 100 mL 溶液进行如下实验:
(1)第一份加足量 NaOH 溶液加热后,收集到气体 0.04 mol。
(2)第二份加足量 BaCl2 溶液后,得干燥沉淀 6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为 2.33 g。
(3)第三份加入 AgNO3 溶液有沉淀产生。根据上述实验,以下推测不正确的是
A.100 mL 溶液中含 0.04 mol NH![]()
B.100 mL 溶液中含 0.01 mol SO42-和 0.02 mol CO32-
C.K+、Cl-可能存在
D.一定不存在Ba2+、Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年度诺贝尔化学奖授予在锂离子电池发展做出贡献的三位科学家。某浓差电池的原理示意如图所示,可用该电池从浓缩海水中提取LiCl溶液。下列有关该电池的说法不正确的是( )
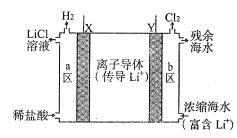
A.该装置可在提取LiCl溶液的同时得电能
B.电子由Y极通过外电路移向X极
C.正极发生的反应为:2H++2e—===H2↑
D.Y极每生成22.4LCl2,有2molLi+从b区移至a区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据预测,到2040年我国煤炭消费仍将占能源结构的三分之一左右。H2S在催化活性碳(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述错误的是
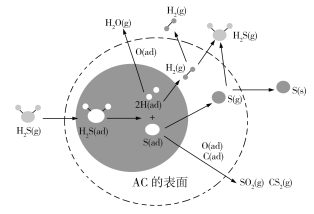
A. 图中阴影部分表示H2S分子的吸附与离解
B. AC表面作用的温度不同,H2S的去除率不同
C. H2S在AC表面作用生成的产物有H2O、H2、S、SO2、CS2等
D. 图中反应过程中只有H—S键的断裂,没有H—S键的形成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com