
【题目】磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05mg·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:
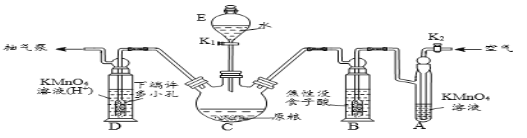
(操作流程)安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。
(实验装置)C中盛100 g原粮,D中盛有 20.00 mL 1.12×10-4 mol L-1KMnO4溶(H2SO4酸化)。
(1)仪器C的名称是_________;原粮最好先打成粉末,其原因是_____________。
(2)磷化钙与水反应化学方程式为_____________________________________;检查整套装置气密性良好的方法是_______________________________________。
(3)A中盛装KMnO4溶液的作用是除去空气中的还原性气体;B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的O2,防止___________;通入空气的作用是____________。
(4)D中PH3被氧化成磷酸,所发生反应的离子方程式为_________________________。
(5)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5mol L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,写出该反应的离子方程式________________,消耗标Na2SO3准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为______mg kg-1。
(6)滴定结束的现象_____________________。
【答案】三颈烧瓶 使原粮中磷化物与水充分反应 Ca3P2 + 6H2O=3Ca(OH)2 +2PH3 关闭K1,打开K2用抽气泵缓慢抽气,若观察到A,B,D的装置中有气泡产生则气密性良好 氧化装置C中生成的PH3 吹出PH3使其全部被酸性高锰酸钾溶液吸收 5PH3 + 8MnO4— +24H+ =5H3PO4 +8Mn2+ + 12H2O 2MnO4—+ 5SO32-+6H+=2Mn2++5SO42- +3H2O 0.0085 滴入最后一滴标准液紫色褪去且30s不恢复
【解析】
(1)根据装置图分析仪器C的名称;原粮打成粉末可以增大与水的接触面积;
(2)磷化钙与水反应生成氢氧化钙和磷化氢;用抽气泵缓慢抽气,依据连续装置中的压强变化判断装置气密性;
(3)PH3具有较强的还原性,用高锰酸钾溶液吸收原粮放出的PH3,根据消耗高锰酸钾的物质的量计算磷化物含量;
(4)D中PH3被高锰酸钾氧化成磷酸,高锰酸钾被还原为锰离子;
(5)高锰酸钾被Na2SO3溶液还原为锰离子,Na2SO3被氧化为Na2SO4;根据方程式计算PH3的含量;
(6)高锰酸钾溶液呈紫色,滴定结束紫色褪去。
(1)根据装置图可知,仪器C的名称是三颈烧瓶;原粮打成粉末可以增大与水的接触面积,使原粮中磷化物与水充分反应;
(2)磷化钙与水反应生成氢氧化钙和磷化氢,化学方程式为Ca3P2 + 6H2O=3Ca(OH)2 +2PH3;检查整套装置气密性良好的方法是:关闭K1,打开K2用抽气泵缓慢抽气,若观察到A、B、D的装置中有气泡产生则气密性良好;
(3)实验原理是:用高锰酸钾溶液吸收原粮放出的PH3,根据消耗高锰酸钾的物质的量计算磷化物含量, B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的O2,防止氧气氧化装置C中生成的PH3;通入空气的作用是吹出PH3使其全部被酸性高锰酸钾溶液吸收。
(4)D中PH3被高锰酸钾氧化成磷酸,高锰酸钾被还原为锰离子,根据得失电子守恒,发生反应的离子方程式为5PH3 + 8MnO4- +24H+ =5H3PO4 +8Mn2+ + 12H2O;
(5)高锰酸钾被Na2SO3溶液还原为锰离子,Na2SO3被氧化为Na2SO4,反应的离子方程式是2MnO4-+ 5SO32-+6H+=2Mn2++5SO42- +3H2O;加水稀释至25mL,用浓度为5×10-5mol/L Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL;依据滴定反应2MnO4-+ 5SO32-+6H+=2Mn2++5SO42- +3H2O 可知2KMnO4~5Na2SO3;未反应的高锰酸钾物质的量=0.011L×5×10-5mol/L×![]() =2.2×10-7mol;与PH3反应的高锰酸钾物质的量= 0.02L×1.12×10-4 molL-1-2.2×10-7mol
=2.2×10-7mol;与PH3反应的高锰酸钾物质的量= 0.02L×1.12×10-4 molL-1-2.2×10-7mol![]() =0.04×10-6mol,根据反应5PH3 + 8MnO4- +24H+ =5H3PO4 +8Mn2+ + 12H2O得到定量关系为:5PH3~8KMnO4,PH3的物质的量为0.04×10-6mol×
=0.04×10-6mol,根据反应5PH3 + 8MnO4- +24H+ =5H3PO4 +8Mn2+ + 12H2O得到定量关系为:5PH3~8KMnO4,PH3的物质的量为0.04×10-6mol×![]() =2.5×10-8 mol,PH3的质量为2.5×10-8 mol×34g/mol=8.5×10-7g,则该原粮中磷化物(以PH3计)的含量为8.5×10-4mg/0.1 kg =0.0085mgkg-1;
=2.5×10-8 mol,PH3的质量为2.5×10-8 mol×34g/mol=8.5×10-7g,则该原粮中磷化物(以PH3计)的含量为8.5×10-4mg/0.1 kg =0.0085mgkg-1;
(6)高锰酸钾溶液呈紫色,滴定结束的现象是滴入最后一滴标准液紫色褪去且30s不恢复。


科目:高中化学 来源: 题型:
【题目】在一定条件下有反应:C6H5OH +CH3I → C6H5OCH3 + HI
![]() +CH3CH2OH→HOCH2CH2OCH2CH3
+CH3CH2OH→HOCH2CH2OCH2CH3
环氧树脂是一类性能优良、使用广泛的聚合物,合成过程可表示如下(反应条件均略去):

双酚A与![]() (环氧氯丙烷)在一定条件下制得环氧树脂:
(环氧氯丙烷)在一定条件下制得环氧树脂:
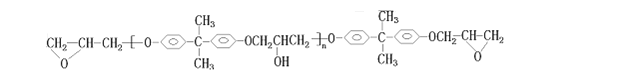
(1)操作①是______;操作②是______(选填序号)
a.分馏 b.裂化 c.裂解
(2)反应①是______;反应②是______(填反应类型)。
(3)完成反应③的化学方程式:_______________________________________________。
(4)在生成环氧树脂的同时还有____________生成。
(5)环氧树脂两端的环氧键可与某些物质反应,使链与链连接起来,这种物质可以是_____(填序号) a.乙醇 b.乙二醇 c.1-丙醇
(6)环氧氯丙烷有多种同分异构体,其中能起银镜反应的有_______种,写出其中一种的系统命名_______________;若双酚A中的H原子被1个D原子取代,则取代的产物有_____种。
(7)工业上由苯制取苯酚有多种方法,如:
方法一: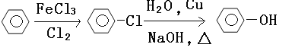
方法二:![]() +2NO
+2NO +N2
+N2
方法二优于方法一之处有:____________________________________________(答一点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C是一种常见塑料,通常具有一定的毒性,不能用于包装熟食;D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空:
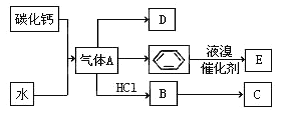
(1)写出A的电子式____;D的空间构型为平面结构,键角为____;
(2)写出碳化钙与水反应制取A的化学方程式___;苯和液溴反应生成E的化学方程式___,其反应类型为____.
(3)B→C的化学方程式___,其反应类型为___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝( AlN)是一种新型无机非金属材料,常温下AlN +NaOH+H2O=NaAlO2+NH3↑。某课题小组利用甲图所示装置测定样品中AlN的含量(杂质不反应)。下列说法中正确的是

A. 量气管中的液体应为水
B. 用长颈漏斗代替分液漏斗,有利于控制反应速率
C. 反应结束时,a、b两管液面的差值即为产生气体的体积
D. 若其它操作均正确,实验结束时按乙图读数,测得AlN含量偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中, xA(g)+yB(g)![]() zC(g)达平衡时A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,A的浓度为0.30mol/L。下列说法正确的是
zC(g)达平衡时A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,A的浓度为0.30mol/L。下列说法正确的是
A.平衡向正反应方向移动 B.x+y<z
C.B的转化率升高 D.C的体积分数下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验测得16 g甲醇CH3OH(l)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25 kJ的热量,试写出甲醇燃烧的热化学方程式: ____________________。
(2)合成氨反应N2(g)+3H2(g) ![]() 2NH3(g)ΔH=a kJ·mol-1,反应过程的能量变化如图所示:
2NH3(g)ΔH=a kJ·mol-1,反应过程的能量变化如图所示:
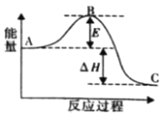
①该反应通常用铁作催化剂,加催化剂会使图中E______(填“变大”或“变小”),E的大小对该反应的反应热有无影响?______(填“有”或“无”)。
②有关键能数据如下:
化学键 | H—H | N—H | N≡N |
键能(kJ·mol-1) | 436 | 391 | 945 |
试根据表中所列键能数据计算a为____________。
(3)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。已知:①N2(g)+2O2(g)=2NO2(g) △Η1=a kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △Η2=bkJ/mol
写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氢氧燃料电池放电时化学能全部转化为电能
B. 反应4Fe(s)+3O2(g)![]() 2Fe2O3(s)常温下可自发进行,该反应为吸热反应
2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C. 3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D. 在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示,遇水易水解,并产生能使品红褪色的气体,S2Br2与S2Cl2结构相似。下列说法错误的是( )
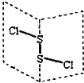
A.S2Cl2中硫原子轨道杂化类型为sp3杂化
B.S2Cl2为含有极性键和非极性键的非极性分子
C.熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. △H>0的化学反应一定不能自发进行
B. 反应2NO2(g)![]() N2O4(l)的熵(体系的混乱度)增大(即△S>0)
N2O4(l)的熵(体系的混乱度)增大(即△S>0)
C. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D. Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com