
【题目】氮化铝( AlN)是一种新型无机非金属材料,常温下AlN +NaOH+H2O=NaAlO2+NH3↑。某课题小组利用甲图所示装置测定样品中AlN的含量(杂质不反应)。下列说法中正确的是

A. 量气管中的液体应为水
B. 用长颈漏斗代替分液漏斗,有利于控制反应速率
C. 反应结束时,a、b两管液面的差值即为产生气体的体积
D. 若其它操作均正确,实验结束时按乙图读数,测得AlN含量偏高
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关硫元素及其化合物的说法或描述正确的是( )
A.硫黄矿制备硫酸经历两步:S![]() SO3
SO3![]() H2SO4
H2SO4
B.酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C.在燃煤中加入石灰石可减少SO2排放,发生的反应为2CaCO3+2SO2+O2![]() 2CO2+2CaSO4
2CO2+2CaSO4
D.土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构。下列有关辛酸的叙述正确的是

A. 辛酸的羧酸类同分异构体中,含有三个“-CH3”结构,且存在乙基支链的共有7种
B. 辛酸的同分异构体(CH3)3CCH(CH3)CH2COOH的名称为2,2,3一三甲基戊酸
C. 正辛酸常温下呈液态而软脂酸常温下呈固态,故二者不符合同一通式
D. 辛酸的同分异构体中能水解生成相对分子质量为74的有机物的共有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验。

下列推断不正确的是
A. 无色溶液B的pH≥7
B. 白色固体F的主要成分是H2SiO3
C. 混合物A中有Na2SiO3、CuSO4和CaCO3
D. 在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3,若有白色沉淀生成,说明混合物A中有KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化的两个重要内容。某兴趣小组做如下探究实验:
(1)如图为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为_____________。反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过_______mol电子。

(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极的反应式为________________。
(3)如图,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,乙装置中石墨(2)电极上发生的反应式为_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝在现代生产和日常生活中应用广泛。
(1)工业上用电解熔融氧化铝的方法来制取金属铝。
①金属铝在_______(填电极名称)生成。
②电解过程中作阳极的石墨易消耗,原因是_______。
(2)英国《自然》杂志近期报道了一种新型可充铝离子电池,以金属铝和石墨为电极,用AlCl4—和有机阳离子构成电解质溶液,其放电工作原理如图所示。
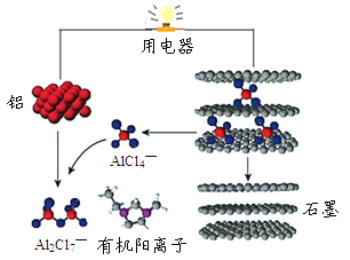
①电池放电时负极的电极反应式为_____。
②充电时有机阳离子向________电极移动(填“铝”或“石墨”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室按如下装置测定纯碱(含少量 NaCl)的纯度。下列说法错误的是
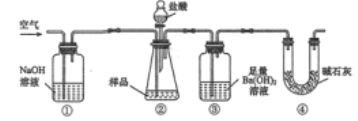
A. 实验前, 应进行气密性检查
B. 必须在装置②、 ③间添加吸收 HCl 气体的装置
C. 装置④的作用是防止空气中的 CO2进入装置③与 Ba(OH)2 溶液反应
D. 反应结束时,应再通入空气将装置②中产生的气体完全转移到装置③中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答问题:
(1)Deacon发明的直接氧化法为:4HCl(g) + O2(g) ![]() 2Cl2(g) +2H2O(g)。如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:可知反应平衡常数K(300℃)_________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比的数据计算c(HCl):c(O2) = 1:1的数据计算K(400℃)=________________(列出计算式即可)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2) 过低、过高的不利影响分别___________________________、____________________________。
2Cl2(g) +2H2O(g)。如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:可知反应平衡常数K(300℃)_________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比的数据计算c(HCl):c(O2) = 1:1的数据计算K(400℃)=________________(列出计算式即可)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2) 过低、过高的不利影响分别___________________________、____________________________。
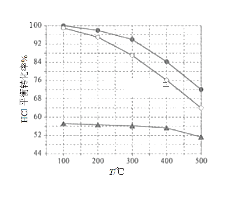
(2)在一定温度的条件下,进一步提高HCl的转化率的方法是__________________________、___________________________________。(写出2种)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com