
【题目】密闭容器中, xA(g)+yB(g)![]() zC(g)达平衡时A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,A的浓度为0.30mol/L。下列说法正确的是
zC(g)达平衡时A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,A的浓度为0.30mol/L。下列说法正确的是
A.平衡向正反应方向移动 B.x+y<z
C.B的转化率升高 D.C的体积分数下降
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法错误的是( )
A.用灼烧的方法可以区分蚕丝和人造纤维
B.食用油反复加热会产生稠环芳香烃等有害物质
C.加热能杀死流感病毒是因为蛋白质受热变性
D.用聚氯乙烯代替聚乙烯作食品包装袋,有利于节约成本
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是实验室蒸馏石油的实验装置,实验需要收集60~150℃和150~300℃的馏分。

请回答下列问题:
(1)仪器a的名称__________,仪器b的名称:b________________。
(2)实验所选温度计是错误的,正确的选择应该是_________________________。
(3)实验时在仪器a中加入了少量碎瓷片,其目的是________________________。
(4)实验时在仪器b中通入冷却水,请指明冷却水的流向_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4—(绿色)、Cr2O72—(橙红色)、CrO42—(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答:
(1)Cr3+与Al3+的化学性质相似,往Cr2(SO4)3溶液中滴入NaOH溶液直至过量,可观察到的现象是 。
(2)CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0molL﹣1的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示。

 ①用离子方程式表示Na2CrO4溶液中的转化反应 。
①用离子方程式表示Na2CrO4溶液中的转化反应 。
②由图可知,溶液酸性增强,CrO42﹣的平衡转化率 (填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为 。
(3)用K2CrO4为指示剂,以AgNO3标准液滴定溶液中的Cl﹣,Ag+与CrO42﹣生成砖红色沉淀时到达滴定终点。当溶液中Cl﹣恰好完全沉淀(浓度等于1.0×10﹣5molL﹣1)时,溶液中c (Ag+)为 molL﹣1,此时溶液中c(CrO42﹣)等于 molL﹣1。(Ksp(Ag2CrO4)=2.0×10﹣12、Ksp(AgCl)=2.0×10﹣10)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72﹣还原成Cr3+,反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+物质的量分别

A. 2 mol、3 mol、6 mol B. 3 mol、2 mol、6mol
C. 2 mol、3 mol、4 mol D. 3 mol、2 mol、2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子的浓度为
A.0.1(b-2a)mol·L-1
B.10(2a-b)mol·L-1
C.10(b-2a)mol·L-1
D.10(b-a)mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式不正确的是
A.工业上可用电解法制备Mg:MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
B.用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+=2Cr3++Fe3++7H2O
C.用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)![]() CaCO3(s)+Na2SO4(aq)
CaCO3(s)+Na2SO4(aq)
D.向Ca(ClO)2溶液中通入少量CO2:Ca2++2C1O-+H2O+CO2=2HC1O+CaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

正极的电极反应式是 。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是 。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;Ⅱ.Fe2+破坏FeO(OH)氧化层。
① 对比实验,结果如图所示,可得到的结论是 。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因: 。
II.高铁酸钠Na2FeO4 是一种新型净水剂。
(4)高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH= 2Na2FeO4+3X+5H2O,则X的化学式为__________。
(5)高铁酸钠具有强氧化性,与水反应生成Fe(OH)3胶体能够吸附水中悬浮杂质,请写出高铁酸钠与水反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
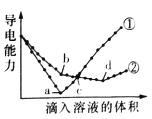
下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.c点,两溶液中含有相同量的OH-
D.a、d两点对应的溶液均显中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com