
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4—(绿色)、Cr2O72—(橙红色)、CrO42—(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答:
(1)Cr3+与Al3+的化学性质相似,往Cr2(SO4)3溶液中滴入NaOH溶液直至过量,可观察到的现象是 。
(2)CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0molL﹣1的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示。

 ①用离子方程式表示Na2CrO4溶液中的转化反应 。
①用离子方程式表示Na2CrO4溶液中的转化反应 。
②由图可知,溶液酸性增强,CrO42﹣的平衡转化率 (填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为 。
(3)用K2CrO4为指示剂,以AgNO3标准液滴定溶液中的Cl﹣,Ag+与CrO42﹣生成砖红色沉淀时到达滴定终点。当溶液中Cl﹣恰好完全沉淀(浓度等于1.0×10﹣5molL﹣1)时,溶液中c (Ag+)为 molL﹣1,此时溶液中c(CrO42﹣)等于 molL﹣1。(Ksp(Ag2CrO4)=2.0×10﹣12、Ksp(AgCl)=2.0×10﹣10)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72﹣还原成Cr3+,反应的离子方程式为 。
【答案】(1)溶液蓝紫色变浅,同时产生灰蓝色沉淀,然后沉淀逐渐溶解形成绿色溶液(2分)
(2)①2CrO42-+2H+![]() Cr2O72-+H2O(2分)②增大(2分)1.0×1014(2分)
Cr2O72-+H2O(2分)②增大(2分)1.0×1014(2分)
(3)2.0×10-5(2分)5.0×10-3(2分)
(4)Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O(2分)
【解析】
试题分析:(1)Cr(OH)3与Al(OH)3的化学性质相似,可知Cr(OH)3是两性氧化物,能溶解在强碱NaOH溶液中,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,首先蓝紫色变浅同时产生Cr(OH)3灰蓝色固体,继续滴加,沉淀溶解,Cr(OH)3变为Cr(OH)4-,溶液最终变为绿色。
(2)①随着H+浓度的增大,CrO42-与溶液中的H+发生反应,因此转化为Cr2O72-的离子反应式为:2CrO42- + 2H+![]() Cr2O72- + H2O。
Cr2O72- + H2O。
②根据化学平衡移动原理,溶液酸性增大,c(H+)增大,化学平衡2CrO42-+2H+![]() Cr2O72-+H2O向正反应方向进行,导致CrO42的平衡转化率增大;根据图像可知,在A点时,c(Cr2O72-)=0.25 mol/L,由于开始时c(CrO42)=1.0 mol/L,根据Cr元素守恒可知A点的溶液中CrO42-的浓度c(CrO42)=0.5 mol/L;H+浓度为1.0×10-7 mol/L;此时该转化反应的平衡常数为
Cr2O72-+H2O向正反应方向进行,导致CrO42的平衡转化率增大;根据图像可知,在A点时,c(Cr2O72-)=0.25 mol/L,由于开始时c(CrO42)=1.0 mol/L,根据Cr元素守恒可知A点的溶液中CrO42-的浓度c(CrO42)=0.5 mol/L;H+浓度为1.0×10-7 mol/L;此时该转化反应的平衡常数为![]() ;
;
(3)当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×105 mol·L1,根据溶度积常数Ksp (AgCl)=2.0×1010,可得溶液中c(Ag+)=Ksp(AgCl)/c(Cl-)=2.0×1010÷(1.0×105mol·L1)=2.0×10-5mol·L1;则此时溶液中c(CrO42)=Ksp(Ag2CrO4)/c2(Ag+)=2.0×1012÷(2.0×10-5 )2=5×10-3mol·L1。
(4)NaHSO3具有还原性,Cr2O72具有氧化性,二者会发生氧化还原反应,根据已知条件,结合电子守恒、电荷守恒、原子守恒,可得二者反应的离子方程式为Cr2O72+3HSO3 +5H+==2Cr3++3SO42+4H2O。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 按K、L、M、N层的顺序,最多容纳的电子数依次增多
B. 原子核外的电子按能量由高到低的顺序先后排在不同的电子层
C. 当M层是最外层时,最多可排布18个电子
D. 稀有气体元素原子的最外层都排有8个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于固定体积的密闭容器中进行的气体反应可以说明A(g) + B(g)![]() C(g)+D(g)已达到平衡的是
C(g)+D(g)已达到平衡的是
A.反应容器的压强不随时间而变化
B.A气体和B气体的生成速率相等
C.A、B、C三种气体的生成速率相等
D.反应混合气体的密度不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列有关实验操作或结果的说法中正确的是 (填字母)。
A.滴定时,眼睛应始终注视滴定管内液面的变化
B.滴定实验都需要指示剂
C.酸碱中和滴定之前,锥形瓶用蒸馏水洗净即可,不能用待测液润洗
D.用pH试纸测量某溶液的pH时要先将试纸润湿
E.滴定管经蒸馏水洗净后,直接注入标准液,将使测得的待测液浓度偏高
F.用广泛pH试纸测量H2SO4溶液的pH时,测得pH=3.2
G.测定酸碱滴定曲线:开始时测试和记录的间隔可稍小些,滴定至终点附近则要大些
(2)NaHSO3溶液显 性,原因 (用化学用语和必要的文字说明),该溶液中离子浓度由大到小排序 。
(3)t℃时,水的离子积KW=1×10-13,pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合(混合液体积变化忽略不计) 若所得混合液的pH=2,则a:b= 。
(4)已知PbI2的Ksp=7.0×10-9,将7.5×10-3mol/L的KI与一定浓度的Pb(NO3)2溶液按2∶1体积比混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为 (填序号)。
A.8.4×10-4 B.5.6×10-4 C.4.2×10-4 D.2.8×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中, xA(g)+yB(g)![]() zC(g)达平衡时A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,A的浓度为0.30mol/L。下列说法正确的是
zC(g)达平衡时A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,A的浓度为0.30mol/L。下列说法正确的是
A.平衡向正反应方向移动 B.x+y<z
C.B的转化率升高 D.C的体积分数下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36g碳不完全燃烧所得气体中,CO占三分之一体积,CO2占三分之二体积,且C(s)+1/2 O2(g)=CO(g) △H=-110.5 kJ/ mol CO(g)+1/2 O2(g)=CO2(g) △H=-283 kJ/ mol与这些碳完全燃烧相比,损失的热量是
A.172.5 kJ B.283 kJ C.517.5 kJ D.1149 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
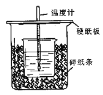
(1)仔细观察实验装置,图中是否缺少一种玻璃用品,如果缺少,缺少的是 (填仪器名称,如果不缺少,此空不填。),图中是否有不妥之处,如果有请指出 (如果没有,此空不填。)
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)用相同浓度和体积的醋酸代替盐酸溶液进行上述实验,测得的中和热△H会 ;(填“偏大”、“偏小”、“无影响”)。
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com