
| 0.448L |
| 22.4L/mol |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 0.448L |
| 22.4L/mol |


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通市海安县高一上学期期末考试化学试卷(带解析) 题型:填空题
(11分)直接排放含二氧化硫、氮氧化物均会危害环境,必须对它们进行处理。
⑴利用钠碱循环法可脱除烟气中的SO2。
①用化学方程式表示SO2形成硫酸型酸雨的反应:
。
②在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反
应的离子方程式是_________ 。
⑵处理氮氧化物的方法很多,以下列举几种常见方法。
①用过量NaOH溶液吸收NO2气体。所得溶液中除含有NaOH和NaNO2,还含有
。
②为避免污染,常给汽车安装尾气净化装置。净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。写出净化过程中的总化学反应方程式:
。
③用氨气可以将其转化为无害气体,发生的 反应为:6NOx+4xNH3=(3+2x)N2+6xH2O。某工厂排出的尾气中NOx的含量为0.56%(体积分数), 若处理1×104L(标准状况)该尾气需42.5gNH3,则x= 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市海淀区高三上学期期末考试化学试卷(解析版) 题型:填空题
硫酸工厂的烟气中含有SO2,有多种方法可实现烟气脱硫。
(1)工业制硫酸的过程中,SO2被氧气氧化的化学方程式为 。
(2)“湿式吸收法”利用吸收剂与SO2发生反应从而脱硫。
已知:25℃时,H2SO3
 HSO3 -+H+
K=1.5×10-2
HSO3 -+H+
K=1.5×10-2
H2CO3 HCO3 -+H+ K=4.4×10-7
HCO3 -+H+ K=4.4×10-7
下列试剂中适合用作该法吸收剂的是 (填字母序号)。
a.石灰乳 b. Na2SO3溶液 c. Na2CO3溶液
②“钠碱法”用NaOH溶液作吸收剂,向100 mL 0.2 mol·L-1 的NaOH溶液中通入标准状况下0.448 L SO2气体,反应后测得溶液pH<7,则溶液中下列各离子浓度关系正确的是 (填字母序号)。
a.c(HSO3-)> c(SO32-)> c(H2SO3)
b.c(Na+)>c(HSO3-)> c(H+)> c(SO32-)
c.c(Na+)+c(H+)= c(HSO3-)+c(SO32-)+c(OH-)
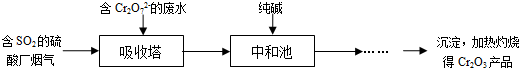
(3)某硫酸厂拟用烟气处理含Cr2O72-的酸性废水,在脱硫的同时制备Cr2O3产品。具体流程如下:

①吸收塔中反应后的铬元素以Cr3+形式存在,则其中发生反应的离子方程式为 。
②中和池中的反应除生成Cr(OH)3沉淀外,还会产生某种气体,该气体的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com