
【题目】下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
![]()
下列说法中不正确的是( )
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
科目:高中化学 来源: 题型:
【题目】元素的原子结构决定其性质和周期表中的位置.下列说法正确的是( )
A. 元素原子的最外层电子数等于元素的最高化合价
B. 多电子原子中,在离核较近的区域内运动的电子的能量较高
C. P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
D. 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A.NH4Fe(SO4)2加入过量NaOH溶液中:NH4++Fe3++4OH-=NH3![]() H2O+Fe(OH)3↓
H2O+Fe(OH)3↓
B.次氯酸钠溶液中通入过量的二氧化硫:ClO-+SO2+H2O=HSO3-+HClO
C.Ba(OH)2溶液和稀硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.澄清的石灰水中加入过量的NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料和新型燃料。
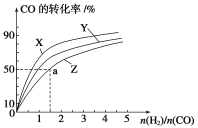
(1)工业上一般以CO和H2为原料在密闭容器中合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.8 kJ·mol-1。在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。下图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是________;该温度下上述反应的化学平衡常数为________;
CH3OH(g) ΔH=-90.8 kJ·mol-1。在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。下图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是________;该温度下上述反应的化学平衡常数为________;
(2)下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。

I.甲中负极的电极反应式为_________ _______
II.乙中反应的化学方程式为______ __ ________;A极析出的气体在标准状况下的体积为________________。
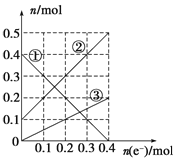
III.丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如下图,则图中②线表示的是________的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要________ mL 5.0 mol·L-1 NaOH溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学平衡常数的说法中,正确的是
A.在任何条件下,化学平衡常数都是一个定值
B.化学平衡常数K可以推断一个可逆反应进行的程度
C.化学平衡常数K只与温度、反应物浓度、体系的压强有关
D.当改变反应物的浓度时,化学平衡常数会发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题:

(1)⑤表示的元素是 (填元素符号);
(2)①、⑤两种元素相比较,原子半径较大的是 (填元素符号);
(3)写出元素③的最高价氧化物对应的水化物与元素④的最高价氧化物对应的水化物相互反应的化学方程式: ;
(4)写出③与⑥两种元素所形成化合物的电子式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大.A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒.
(1)A元素的第一电离能 B元素的第一电离能(填“<”“>”或“=”),A、B、C三种元素电负性由小到大的顺序为 (用元素符号表示).
(2)D元素原子的价电子排布式是 .
(3)C元素的电子排布图为 ;E3+的离子符号为 .
(4)F元素位于元素周期表的 区,其基态原子的电子排布式为 .
(5)G元素可能的性质 .
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com