
【题目】摩拜单车可利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,电池反应原理为:LiCoO2+6C![]() Li1-xCoO2+LixC6,结构如图所示,下列说法错误的是
Li1-xCoO2+LixC6,结构如图所示,下列说法错误的是
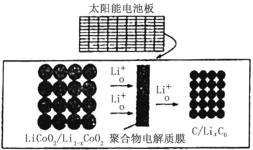
A.充电时,阴极质量增加,发生还原反应
B.充电时,电路中每有1mol电子转移,则有1molLi+由左向右通过聚合物电解质膜
C.该锂离子电池工作时,化学能转化为电能
D.放电时,正极的电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+
【答案】D
【解析】
分析题给电池反应原理:LiCoO2+6C![]() Li1-xCoO2+LixC6,充电时,阳极失去电子,发生氧化反应,阴极得到电子发生还原反应;放电时,正极得电子发生还原反应,负极失电子发生氧化反应。结合题中结构图可知,聚合物电解质膜为阳离子交换膜,据此进行分析。
Li1-xCoO2+LixC6,充电时,阳极失去电子,发生氧化反应,阴极得到电子发生还原反应;放电时,正极得电子发生还原反应,负极失电子发生氧化反应。结合题中结构图可知,聚合物电解质膜为阳离子交换膜,据此进行分析。
A.充电时,阳极生成Li+,Li+向阴极(C极)移动,阴极得电子发生还原反应,电极反应方程式为:6C+xLi++xe-=LixC6,阴极质量增加,A项正确;
B.充电时,阳极失电子发生氧化反应,电极反应方程式为:LiCoO2-xe-=Li1-xCoO2+xLi+,电路中每有1mol电子转移,则有1molLi+由装置左侧通过聚合物电解质膜移向右侧,B项正确;
C.锂离子电池工作时,为放电过程,化学能转化为电能,C项正确;
D.放电时,正极得电子发生还原反应,电极反应方程式为:Li1-xCoO2+xLi++xe-= LiCoO2。D项错误;
答案选D。


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由链状化合物B(C4H4O4)通过以下反应制取。通常状况下B为无色晶体,与碳酸氢钠溶液反应生成C4H2O4Na2,B没有支链。

下列说法正确的是( )
A.B中只含一种官能团:羧基
B.反应①属于取代反应
C.反应②属于加成反应
D.天门冬氨酸的结构简式为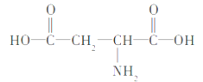
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10.8g表面被氧化的金属钠投入到足量的水中得到溶液200mL,并生成2.24L的气体(标准状况下)。往得到的溶液中通入一定量的CO2气体,充分反应后将溶液低温蒸干,得到固体27.4g。求:
(1)原金属中单质钠的质量分数(保留一位小数)___;
(2)所得200mL溶液的物质的量浓度___;
(3)通入的CO2在标准状况下的体积___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用海水制备金属镁的流程如图所示,请据图回答下列问题:

(1)贝壳主要成分的化学式是__。
(2)第②步是用生石灰和水反应制取石灰乳(主要成分是氢氧化钙)请写出制取石灰乳的化学方程式:__,基本反应类型是__。
(3)第③步是将沉淀出的氢氧化镁与盐酸反应生成氯化镁,写出该反应的化学方程式:__,该反应基本类型是__。
(4)第④步是无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式:___,反应基本类型是__。
(5)要使海水中MgCl2完全转化为沉淀Mg(OH)2,加入石灰乳的量应过量,确定海水中的MgCl2已全部转化为Mg(OH)2的方法:取上层清液少量,向其中加入氢氧化钠溶液,观察到__。
(6)海水中本来就有氯化镁,请分析从海水中制取MgCl2时,要经历“MgCl2→Mg(OH)2→MgCl2”的转化原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,pH=2的某酸HnA(An—为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为5。下列判断正确的是
A.生成的正盐化学式为BmAn
B.该盐中存在着一定水解的离子,该离子水解方程式为Bm++mH2O![]() B(OH)m+mH+
B(OH)m+mH+
C.生成的盐为强酸弱碱盐
D.HnA为弱酸,其第一步电离方程式为HnA![]() Hn-1A-+H+
Hn-1A-+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下转化关系,E为淡黄色粉末,通常用在呼吸面具中作为氧气的来源。

(1)A、C、E、F的化学式:
A______,C______,E______,F______。
(2)向饱和的C的溶液中通入足量CO2,会出现的现象是_____,有关反应的化学方程式为____。
(3)鉴别C与F溶液应选用的试剂是_____,有关反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室研究某些气体的性质可用如图所示装置,下列过程和结论均正确的是

项选 | X | Y | Z | 结论 |
A | Br2 | 苯 | NaOH 溶液 | 苯与溴发生取代反应 |
B | SO2 | 酸性KMnO4溶液 | NaOH 溶液 | 二氧化硫具有漂白性 |
C | HCl | Na2SiO3溶液 | NaCl 溶液 | Cl 的非金属性强于Si |
D | CH2= CH2 | Br2 的CCl4溶液 | AgNO3溶液 | 乙烯与Br2发生加成反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)COCl2的空间构型为______________,溴的基态原子价电子排布式为_____________。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____________(填字母)式发生。
A.CsICl2====CsCl+ICl B.CsICl2====CsI+Cl2
(3)根据表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是____。
元素 | 氟 | 氯 | 溴 | 碘 |
第一电离能/ (kJ·mol-1) | 1681 | 1251 | 1140 | 1008 |
(4)下列分子既不存在“s-p”σ键,也不存在“p-p”π键的是__________(填字母)。
A.HCl B.HF C.SO2 D.SCl2
(5)已知ClO2-为“V”形,中心氯原子周围有4对价层电子。ClO2-中心氯原子的杂化轨道类型为______________,写出一个与CN—互为等电子体的物质的分子式:______________。
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断钙的氧化物的化学式为__________。已知该氧化物的密度是ρg·cm-3,则晶胞内离得最近的两个钙离子的间距为_________cm(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照下列元素基态原子的电子排布特征判断元素,并回答问题:
A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后不能再容纳外来电子;C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)以下分别是哪种元素(用元素符号填空):
A:_____________;C:_____________;D:____________;
(2)B原子的核外电子排布式_____________;写出A的负一价阴离子的电子式_____________。
(3)E的原子结构示意图_____________。
(4)写出由A、C两元素形成的18e-分子的形成过程:_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com