
【题目】25℃时,pH=2的某酸HnA(An—为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为5。下列判断正确的是
A.生成的正盐化学式为BmAn
B.该盐中存在着一定水解的离子,该离子水解方程式为Bm++mH2O![]() B(OH)m+mH+
B(OH)m+mH+
C.生成的盐为强酸弱碱盐
D.HnA为弱酸,其第一步电离方程式为HnA![]() Hn-1A-+H+
Hn-1A-+H+
【答案】D
【解析】
25℃时,pH=2的某酸HnA(An—为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为5。说明HnA为弱酸,且酸过量。根据化合物中化合价的代数和为0可以确定其化学式,根据酸碱的相对强弱可以确定水解的离子。
A.HnA中A的化合价为-n价,碱B(OH)m中B的化合价是+m价,根据化合物中化合价的代数和为0可知,二者的离子个数比为:n:m,则其化学式为BnAm,A项错误;
B.根据题意可知HnA为弱酸,则An–一定能水解,水解方程式为:An–+H2O![]() HA(n-1)–+OH-,B项错误;
HA(n-1)–+OH-,B项错误;
C.根据题意可知HnA为弱酸,生成的盐为弱酸强碱盐,C项错误;
D.HnA为弱酸,在水溶液中部分电离成酸根离子和氢离子,电离方程式为:HnA![]() Hn-1A-+H+,D项正确;
Hn-1A-+H+,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】我国科学家成功地在铁掺杂W18O49纳米催化剂表面常温下获得较高的氨产量,反应历程如图所示(★表示被吸附在催化剂表面的物种)。下列说法错误的是
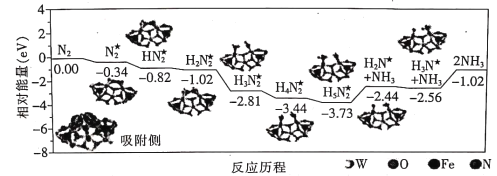
A.需要吸收能量的最大能垒(活化能)E=1.54eV
B.吸收能垒为1.29 eV步骤的反应为H5N2★=NH3+H2N★
C.选择镍掺杂W18O49纳米催化剂获得反应历程与上述不同
D.投料比[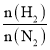 ]越大,单位时间内合成氨的产量越高
]越大,单位时间内合成氨的产量越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
晶体硼(其每个结构单元中有12个B原子) | NaCl | S8 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点2573K | —— | 易溶于CS2 | —— |
A.晶体硼属于原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.NaCl晶体中每个Na+周围距离最近且相等的Na+有6个
C.S8分子中的共价键为非极性键
D.HCN分子中含有2个σ键,2个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知反应:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-99kJ·mol-1,在V2O5存在时的反应机理为:①V2O5+SO2→V2O4·SO3(快),②V2O4·SO3+
SO3(g) △H=-99kJ·mol-1,在V2O5存在时的反应机理为:①V2O5+SO2→V2O4·SO3(快),②V2O4·SO3+![]() O2→V2O5+SO3(慢)。下列说法错误的是
O2→V2O5+SO3(慢)。下列说法错误的是
A.对总反应的速率起决定性的是反应②
B.将1molSO2(g)、0.5molO2(g)置于密闭容器中充分反应,放出热量99kJ
C.V2O4·SO3是该反应的中间产物,它与O2的碰撞仅部分有效
D.V2O5是该反应的催化剂,加V2O5可提高单位时间内SO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N断裂的同时,有3个H—H键断裂
②一个N≡N键断裂的同时,有6个N—H键断裂
③其它条件不变时,混合气体平均相对分子质量不再改变
④恒温恒容时,体系压强不再改变
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体的密度保持不变
⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A.全部B.①③④⑤C.②③④⑤⑦D.③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩拜单车可利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,电池反应原理为:LiCoO2+6C![]() Li1-xCoO2+LixC6,结构如图所示,下列说法错误的是
Li1-xCoO2+LixC6,结构如图所示,下列说法错误的是
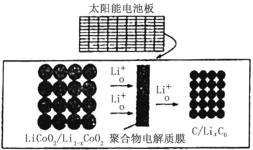
A.充电时,阴极质量增加,发生还原反应
B.充电时,电路中每有1mol电子转移,则有1molLi+由左向右通过聚合物电解质膜
C.该锂离子电池工作时,化学能转化为电能
D.放电时,正极的电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据如图所示的关系:
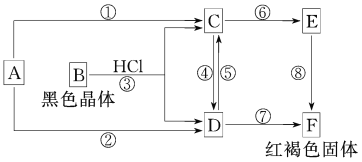
(1)确定A、B、C、D、E、F的化学式:A____________,B____________,C____________,D____________,E____________,F____________。
(2)写出⑧的化学方程式________,④、⑤的离子方程式________,_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬渣是生产金属铬和铬盐过程中产生的工业废渣,其中含有Na2SO4及少量Cr2O72—、Fe3+。从铬渣中提取Na2SO4的工艺流程:
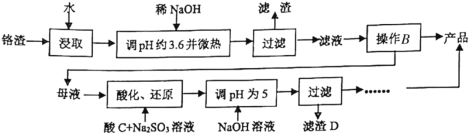
已知:常温时,Fe3+、Cr3+完全沉淀时c≤1×10-5mol·L-1,Ksp[Fe(OH)3]=4×10-38,Ksp[Cr(OH)3]=6×10-31。
(1)调pH约为3.6目的是_________。
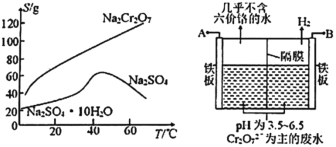
(2)根据下图溶解度(S)—温度(T)曲线,判断操作B为蒸发浓缩、_________________。
(3)“酸化、还原”步骤反应的离子方程式为_______________________________。
(4)滤渣D为________________________(填化学式)。
(5)如图,某工厂采用电解法处理含铬废水,用铁板作阴阳极,槽中盛放含铬废水,A接电源的_______极;阳极区溶液中发生的氧化还原反应为__________________。若不考虑气体的溶解,当收集到6.72L(标准状况)的H2时,理论上有___molCr2O72—被还原。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知Al(OH)3是两性氢氧化物,但不溶于弱碱溶液氨水,也不溶于弱酸碳酸。试用离子方程式说明原理:_____、_____。
(2)分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子均满足8电子稳定结构。写出(CN)2的电子式_____。
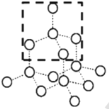
(3)请在下图的虚线框中补充完成SiO2晶体的结构模型示意图____,(部分原子已画出),并进行必要的标注。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com