
【题目】(1)已知Al(OH)3是两性氢氧化物,但不溶于弱碱溶液氨水,也不溶于弱酸碳酸。试用离子方程式说明原理:_____、_____。
(2)分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子均满足8电子稳定结构。写出(CN)2的电子式_____。
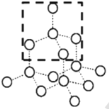
(3)请在下图的虚线框中补充完成SiO2晶体的结构模型示意图____,(部分原子已画出),并进行必要的标注。
【答案】![]() +
+![]() +2H2O=Al(OH)3↓+NH3H2O Al3++3
+2H2O=Al(OH)3↓+NH3H2O Al3++3![]() =Al(OH)3↓+3CO2↑或 2Al3++3
=Al(OH)3↓+3CO2↑或 2Al3++3![]() +3H2O=2Al(OH) 3↓+3CO2↑
+3H2O=2Al(OH) 3↓+3CO2↑ ![]()
【解析】
(1)偏铝酸钠和氯化铵发生双水解反应生成氢氧化铝和氨水,证明氢氧化铝不溶于氨水,反应的离子方程式是![]() +
+![]() + 2H2O=Al(OH)3↓+NH3H2O;氯化铝和碳酸氢钠溶液反应生成氢氧化铝沉淀和二氧化碳,证明氢氧化铝不溶于碳酸,反应的离子方程式是Al3++3
+ 2H2O=Al(OH)3↓+NH3H2O;氯化铝和碳酸氢钠溶液反应生成氢氧化铝沉淀和二氧化碳,证明氢氧化铝不溶于碳酸,反应的离子方程式是Al3++3![]() =Al(OH)3↓+3CO2↑;
=Al(OH)3↓+3CO2↑;
(2) (CN)2分子中每个原子均满足8电子稳定结构,(CN)2的电子式是![]() ;
;
(3) SiO2晶体中1个硅原子和4个氧原子形成4个硅氧单键,每个氧原子和2个硅原子形成2个氧硅单键,SiO2晶体的结构模型示意图为 。
。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】25℃时,pH=2的某酸HnA(An—为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为5。下列判断正确的是
A.生成的正盐化学式为BmAn
B.该盐中存在着一定水解的离子,该离子水解方程式为Bm++mH2O![]() B(OH)m+mH+
B(OH)m+mH+
C.生成的盐为强酸弱碱盐
D.HnA为弱酸,其第一步电离方程式为HnA![]() Hn-1A-+H+
Hn-1A-+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A.在火柴头浸取的水溶液中滴入AgNO3溶液,稀硝酸溶液检验氯元素时离子反应:Ag++Cl-=AgCl↓
B.NaNO2溶液中滴加适量稀盐酸:2![]() +2H+=H2O+NO↑+NO2↑
+2H+=H2O+NO↑+NO2↑
C.向Cu(NO3)2溶液中加入过量氨水:Cu2++2NH3H2O= Cu(OH)2↓+2![]()
D.苯酚与三氯化铁溶液反应,得到溶液显紫色:6C6H5O-+Fe3+=[Fe(OC6H5)6]3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,中国科学院大连化物所CO2催化转化为CO的研究获得新成果。下图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化,下列说法正确的是
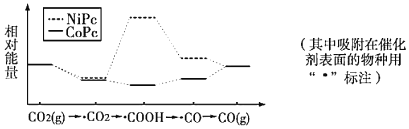
A.CO2(g)→CO(g)+l/2O2(g)过程中能量降低
B.CO2经氧化反应得到COOH
C.该条件下,催化剂NiPc比CoPc对CO2(g)→CO(g)转化效率更高
D.该研究成果将有利于缓解温室效应并解决能源转化问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2),还可制备甲醇、二甲醚、低碳烯烃等燃料产品。
I.制合成气
科学家提出制备:“合成气”反应历程分两步:
反应①: CH4(g)C(ads)+2H2(g) (慢反应)
反应②:C(ads)+CO2(g)2CO(g) (快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如下图:

(1) CH4与CO2制备“合成气”的热化学方程式为____。 能量变化图中:E5+E1_______E4+ E2(填“>” 、 “< ” 或 “= ”)。
II.甲醇合成
在某 CO 催化加氢制甲醇的反应体系中,发生的主要反应有:
i. CO2(g) + 3 H2(g)CH3OH(g)+H2O(g)△H1< 0
ii.CO2(g) + H2(g)CO (g)+H2O(g) △H2>0
iii . CO(g)+2H2( g)CH3OH(g) (g) △H3< 0
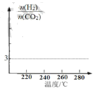
(2)5MPa 时,往某密闭容器中按投料比n(H2) :n ( CO2) =3:1 充入H2和CO2。反应达到平衡时, 测得各组分的物质的量分数随温度变化的曲线如图所示。

①体系中CO2的物质的量分数受温度的影响不大, 原因是_____。
②250°C时,反应 i i 的平衡常数____1(填“> ”“< ”或“=”)
③下列措施中,无法提高甲醇产率的是____(填标号)。
A.加入适量CO B.增大压强 C.循环利用原料气 D.升高温度
④在下图中画出n(H2)/ n(CO2)随温度变化趋势图_____。
(3)反应i可能的反应历程如下图所示。
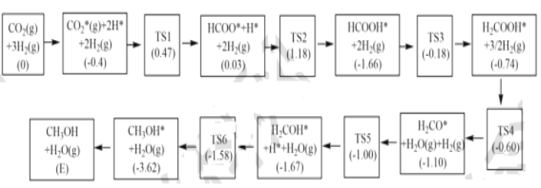
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:eV)。其中TS表示过渡态、*表示吸附在催化剂上的微粒,反应历程中,生成甲醇的决速步骤的反应方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照下列元素基态原子的电子排布特征判断元素,并回答问题:
A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后不能再容纳外来电子;C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)以下分别是哪种元素(用元素符号填空):
A:_____________;C:_____________;D:____________;
(2)B原子的核外电子排布式_____________;写出A的负一价阴离子的电子式_____________。
(3)E的原子结构示意图_____________。
(4)写出由A、C两元素形成的18e-分子的形成过程:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O;关于该反应的下列说法不正确的是( )
NaCl+N2↑+2H2O;关于该反应的下列说法不正确的是( )
A. Na2NO2是氧化剂,NH4Cl是原剂
B. N2既是氧化产物,又是还原产物
C. NH4Cl中氮元素被还原
D. 每生成1molN2转移电子的物质的量为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;由A通过聚合反应生成高分子化合物F,F可用于工业合成塑料,现以A为主要原料合成G,以A为原料的合成路线如下图所示。

回答下列问题:
(1)D、G分子中的官能团名称分别__________、__________。
(2)在反应①~⑥中,属于加成反应的是______,属于取代反应的是_____。(填序号)
(3)写出与G分子式相同的所有羧酸类的同分异构体:_________________
(4)写出由C与新制氢氧化铜反应的化学方程式:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用乙醚、95%乙醇浸泡杜仲干叶,得到提取液,进步获得绿原酸粗产品的种工艺流程如下,下列说法错误的是
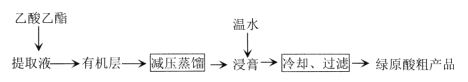
A.常温下,绿原酸易溶于水
B.浸膏的主要成分是绿原酸
C.减压蒸馏的目的是降低蒸馏温度,以免绿原酸变质
D.绿原酸粗产品可以通过重结晶进一步提纯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com