
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。某化学兴趣小组进行如下有关SO2性质和含量测定的探究活动。
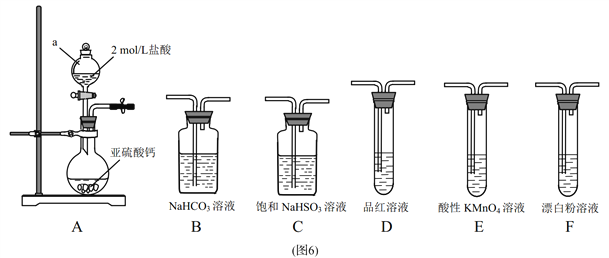
(1)装置 A 中仪器a的名称为 ____________。
(2)选用图6中的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按 A→C→F→尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是_________________________。
②丙同学设计的合理实验方案为:按照 A→C→____ →E→_____ →F→尾气处理(填字母)顺序连接装置。 E装置的作用是________,证明亚硫酸的酸性强于次氯酸的实验现象是_______ 。
(3)为了测定装置A残液中SO2的含量,量取10.00mL残液于圆底烧瓶中,加热使SO2全部蒸出,用20.00mL0.0500mol/L的酸性KMnO4溶液吸收。充分反应后,再用0.2 000mol/L的K I标准溶液滴定过量的 KMnO 4,消耗 KI溶液15.00mL。
已知:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
10I- +2MnO4-+16H+=2Mn 2+ +5I 2+8H2O
①残液中SO 2 的含量为_______ g·L-1。
②若滴定过程中不慎将 KI标准溶液滴出锥形瓶外少许,使测定结果______(填“偏高”、“偏低”或“无影响”)。
【答案】 分液漏斗 二氧化硫通入次氯酸钙溶液发生了氧化还原反应,不能证明强酸制备弱酸的原理 B D 除去 CO2 中混有的SO2 装置 D中品红溶液不褪色,F中出现白色沉淀 6.4 偏低
【解析】(1)装置A中仪器a的名称为分液漏斗。
(2)①要证明酸性强弱,根据强酸制弱酸原理,相对强酸于弱酸盐发生复分解反应生成弱酸,而二氧化硫通入次氯酸钙溶液发生了氧化还原反应,故不能证明强亚硫酸和次氯酸的酸性强弱。②根据丙同学的部分设计流程可看出,丙同学用间接方法证明亚硫酸和次氯酸的酸性强弱,先证明亚硫酸酸性强于碳酸,再证明碳酸酸性强于次氯酸,故流程为:A→C→_B_ →E→_D_→F→尾气处理;A产生SO2,C除去挥发出的HCl气体,B验证亚硫酸酸性强于碳酸,E除去CO2中混有的SO2,D确认SO2已被除尽,F证明碳酸酸性强于次氯酸,若装置D中品红溶液不褪色,F中出现白色沉淀,则可证明亚硫酸的酸性强于次氯酸。
(3)①由已知,与SO2反应的KMnO4等于总的KMnO4减去与KI反应的KMnO4,即0.02L×0.05molL-1-![]() ×0.015L×0.2molL-1=0.0004mol;由第一个反应可得:n(SO2)=
×0.015L×0.2molL-1=0.0004mol;由第一个反应可得:n(SO2)=![]() ×0.0004mol=0.001mol,m(SO2)=0.001mol×64 gmol-1=0.064g,所以残液中SO2的含量为0.064g÷0.01L=6.4g·L-1。②若滴定过程中不慎将KI标准溶液滴出锥形瓶外少许,则测得与KI反应的KMnO4偏大,那么得到与SO2反应的KMnO4偏小,则SO2的含量偏低。
×0.0004mol=0.001mol,m(SO2)=0.001mol×64 gmol-1=0.064g,所以残液中SO2的含量为0.064g÷0.01L=6.4g·L-1。②若滴定过程中不慎将KI标准溶液滴出锥形瓶外少许,则测得与KI反应的KMnO4偏大,那么得到与SO2反应的KMnO4偏小,则SO2的含量偏低。


 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】NaClO2是重要的含氯化工产品,工业上生产NaClO2有多种方法,某工业生产的流程图如下:

(1)NaClO2氯元素的化合价为___________。
(2)电解槽中阳极上的电极反应式为_______________。
(3)反应器Ⅰ中发生友应的化学方程式为___________;反应器Ⅱ中发生的反应中氧化剂与还原剂物质的量之比为_________________。
(4)流程中①、②在工业生产中的现实意义是__________;已知NaClO2饱和溶液在温度低于38℃时析出NaClO2·3H2O晶体,高于38℃时析出NaClO2晶体,高于60℃时NaClO2分解,则从流程中获得的NaClO2溶液中得到NaClO2晶体的步骤为:_______用30℃-60℃热水洗涤、低于60℃干燥。
(5)产品中NaClO2含量的测定:准确称取a g NaClO2样品放入锥形瓶中,加适量水溶解后,加入过量的一定浓度的KI溶液、淀粉溶液,然后再滴加稀硫酸使样品中的NaClO2恰好全部被还原为NaCl,再用c mol/L Na2S2O3溶液滴定,发生反应I2+2S2O32-=2I-+S4O62-,消耗Na2S2O3溶液的体积为V mL。
① 盛装Na2S2O3溶液应选用______式滴定管,到达滴定终点时的现象为________.
② 产品中NaClO2的质量分数w(NaClO2)=______(用含c、V、a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
①活化分子间的碰撞一定能发生化学反应 ②普通分子间的碰撞有时也能发生化学反应 ③一般说来,活化分子比普通分子具有更高的能量 ④化学反应的实质是原子的重新组合 ⑤化学反应的实质是旧化学键断裂和新化学键形成的过程 ⑥化学反应的实质是活化分子有合适取向时的有效碰撞
A.①③④⑤ B.②③⑥ C.③④⑤⑥ D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制作馒头时,需加入纯碱(成分是碳酸钠),如果纯碱加多了,蒸出的馒头发黄且口感不好。为除去面团中过多的纯碱,向面团中加入适量的( )
A.食醋B.食盐C.料酒D.味精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应aA(g)+bB(g)![]() cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图

回答问题:
(1)反应的化学方程式中,a:b:c为________;
(2)A的平均反应速率VI(A)、vII(A)、vIII(A)从大到小排列次序为________;
(3)B的平衡转化率aI(B)、aII(B)、aIII(B)中最小的是_________;
(4)由第一次平衡到第二次平衡,平衡移动的方向是_______________;
(5)比较第II阶段反应温度(T2)和第III阶段反应温度(T3)的高低:T2___T3(填“>、=、<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上主要利用碳热还原重晶石制得硫化钡,进而生产各种钡化合物。下图为不同反应温度下,实验中碳热还原硫酸钡反应体系的平衡组成随反应温度的变化关系。下列说法正确的是
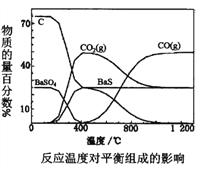
A. 约150℃,体系中开始出现BaS,说明温度越高反应速率越快
B. 400℃时发生的化学反应方程式: BaSO4+2C![]() BaS+2CO2
BaS+2CO2
C. CO—定无法还原重晶石
D. 温度高于400℃后,硫酸钡才能转化为BaS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析细胞内4种重要有机物的组成及功能,回答下列问题:

(1)A一般是指______;E在动物细胞中是指________
(2)F是指________;除此之外,脂质还包括磷脂和________两大类。
(3)C的结构通式是_________,[G]是指________,C形成[G]的过程叫______________。
(4)构成人体的遗传物质的中文全称是________________,如果碱基是T,则D的全称是_________。如果碱基是U,则D的全称是_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com