
下列符号表示的轨道中具有球对称性的是( )。
A.7s B.4f C.5d D.3p
科目:高中化学 来源:2014年化学高考总复习单元检测 第九章电化学基础练习卷(解析版) 题型:填空题
能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8 kJ/mol、282.5 kJ/mol、726.7 kJ/mol。请回答:
(1)已知CO和H2在一定条件下可以合成甲醇:CO+2H2=CH3OH。则H2与CO反应生成CH3OH的热化学方程式为: 。
(2)如图为某种燃料电池的工作原理示意图,a、b均为惰性电极。

①使用时,空气从 口通入(填“A”或“B”);
②假设使用的“燃料”是甲醇,a极的电极反应式为: ________________
③假设使用的“燃料”是水煤气(成分为CO、H2)用这种电池电镀铜,待镀金属增重6.4 g,则至少消耗标准状况下水煤气的体积为 。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考复习演练4-5海水资源利用环境保护绿色化学练习卷(解析版) 题型:实验题
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
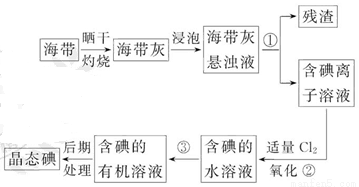
(1)步骤①的实验操作名称是_________;
(2)现有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品。完成该实验尚缺少的玻璃仪器是_________;
(3)步骤③中能选用CCl4从碘水中萃取碘的原因是_________;
A.CCl4与水不互溶
B.CCl4可与I2发生取代反应
C.CCl4的密度比水大
D.CCl4不易燃烧,可作灭火剂
E.碘在CCl4中的溶解度比在水中大很多
(4)步骤③中还可选择_________作萃取剂;
(5)步骤②中反应的离子方程式是__________________________________;
(6)请设计一种简单的实验方法,检验提取碘后的水溶液中是否还含有单质碘:_________。
查看答案和解析>>
科目:高中化学 来源:2014学年高二鲁科选修3化学训练1.2.1基态原子核外电子排布练习卷(解析版) 题型:选择题
下列各原子或离子的电子排布式错误的是( )。
A.C 1s22s22p2
B.O2- 1s22s22p6
C.Cr 1s22s22p63s23p63d44s2
D.Al3+ 1s22s22p6
查看答案和解析>>
科目:高中化学 来源:2014学年高二鲁科选修3化学规范训练1.1.2原子核外电子运动练习卷(解析版) 题型:选择题
下面有关“核外电子的运动状态”的说法,其中错误的是( )。
A.能级是描述电子运动的电子云形状
B.只有在电子层、能级、电子云的伸展方向及电子的自旋状态都确定时,电子的运动状态才能被确定下来
C.必须在B项所述四个方面都确定时,才能确定组成每一电子层的最多轨道数
D.电子云伸展方向与能量大小是无关的
查看答案和解析>>
科目:高中化学 来源:2014学年高二鲁科版选修3化学规范训练 1章原子结构练习卷(解析版) 题型:填空题
Ⅰ.某元素有6个电子处于第三电子层d轨道上,推测该元素的原子序数是________,并根据洪特规则推测在第三电子层d轨道上未成对电子的个数是________个。
Ⅱ.核电荷数小于18的两种元素,A原子最外层电子数为a个,次外层电子数为b个;B原子M层电子数为(a-b)个,L层为(a+b)个,则:
(1)写出元素的名称和符号:A.____________________,B.____________________。
(2)写出各原子的核外电子排布的轨道表示式。
查看答案和解析>>
科目:高中化学 来源:2014学年高二鲁科版选修3化学规范训练 1章原子结构练习卷(解析版) 题型:选择题
若短周期的两元素可形成原子个数比为2∶3的化合物,则这两种元素原子序数之差不可能是( )。
A.1 B.3 C.5 D.6
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 2章化学反应与能量练习卷(解析版) 题型:选择题
一定温度下,反应2SO2(g)+O2(g)  2SO3(g),达到平衡时,n(SO2)∶n(O2)∶n(SO3)=2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物质的量应是( )。
2SO3(g),达到平衡时,n(SO2)∶n(O2)∶n(SO3)=2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物质的量应是( )。
A.0.4 mol B.0.6 mol C.0.8 mol D.1.2 mol
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 2.2.2发展中的化学电源练习卷(解析版) 题型:填空题
铅蓄电池是典型的可充电电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42— 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
放电时:正极的电极反应式是______________________________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com