
ΓΨΧβΡΩΓΩ“―÷ΣΤχΧ§ΧΰA‘Ύ±ξΉΦΉ¥Ωωœ¬ΒΡΟήΕ» «1.25gΓΛL-1Θ§BΓΔCΓΔDΓΔEΨυΈΣ≥ΘΦϊΒΡ”–ΜζΈο, ‘Ύ“ΜΕ®ΧθΦΰœ¬Θ§ΥϋΟ«”–»γœ¬ΆΦΥυ ΨΒΡΉΣΜ·ΙΊœΒΓΘ

«κΜΊ¥π:
(1) AΖ÷Ή”÷–ΙΌΡήΆ≈ΒΡΟϊ≥Τ «_______Θ§Ρή”κΫπ τΡΤΖ¥”ΠΖ≈≥ω«βΤχΒΡΈο÷ ”–______ (ΧνΉ÷ΡΗ)ΓΘ
(2)Ζ¥”ΠΔίΒΡΜ·―ßΖΫ≥Χ Ϋ «____________________ ( ”–ΜζΈο”ΟΫαΙΙΦρ Ϋ±μ Ψ)ΓΘ
(3)œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «___________
AΘ° Β―ι “÷Τ±ΗD ±ΫΪ…ζ≥…ΒΡDάδΡΐΒΫΉΑ”–Υ°ΒΡ ‘ΙήάοΘ§“‘≥ΐ»ΞD÷–…ΌΝΩΒΡ‘”÷
BΘ°Ζ¥”ΠΔή τ”Ύ»Γ¥ζΖ¥”Π
CΘ°œύΆ§Έο÷ ΒΡΝΩΒΡAΓΔBΜρC≥δΖ÷»Φ…’ ±œϊΚΡΒ»ΝΩΒΡ―θΤχ
DΘ°ΤœΧ―Χ«‘Ύ“ΜΕ®ΧθΦΰœ¬Ζ÷ΫβΩ…“‘…ζ≥…”–ΜζΈοB
ΓΨ¥πΑΗΓΩΧΦΧΦΥΪΦϋ BC CH3COOCH2CH3+NaOHΓζCH3CH2OH+CH3COONa AC
ΓΨΫβΈωΓΩ
ΤχΧ§ΧΰA‘Ύ±ξΉΦΉ¥Ωωœ¬ΒΡΟήΕ» «1.25gΓΛL-1Θ§‘ρΤδΡΠΕϊ÷ ΝΩΈΣ1.25gΓΛL-1ΓΝ22.4L/mol=28g/molΘ§¥”ΕχΒΟ≥ωAΈΣ““œ©CH2=CH2ΘΜBΓΔCΓΔDΓΔEΨυΈΣ≥ΘΦϊΒΡ”–ΜζΈοΘ§«“BΓΔCΖ¥”ΠΡή…ζ≥…DΘ§D‘ΎΦν–‘ΧθΦΰœ¬Υ°Ϋβ”÷Ρή…ζ≥…BΘ§‘ρBΈΣCH3CH2OHΘ§¥”ΕχΒΟ≥ωCΈΣCH3COOHΘ§DΈΣCH3COOCH2CH3Θ§EΈΣCH3COONaΓΘ
(1)”…“‘…œΖ÷ΈωΩ…÷ΣΘ§AΈΣCH2=CH2Θ§AΖ÷Ή”÷–ΙΌΡήΆ≈ΒΡΟϊ≥Τ «ΧΦΧΦΥΪΦϋΘ§Ρή”κΫπ τΡΤΖ¥”ΠΖ≈≥ω«βΤχΒΡΈο÷ ”–““¥ΦΚΆ““ΥαΘ§Ι ―ΓBCΓΘ¥πΑΗΈΣΘΚΧΦΧΦΥΪΦϋΘΜBCΘΜ
(2)Ζ¥”ΠΔίΈΣCH3COOCH2CH3‘ΎΦν–‘ΧθΦΰœ¬ΒΡΥ°ΫβΖ¥”ΠΘ§Μ·―ßΖΫ≥Χ Ϋ «CH3COOCH2CH3+NaOHΓζCH3CH2OH+CH3COONaΓΘ¥πΑΗΈΣΘΚCH3COOCH2CH3+NaOHΓζCH3CH2OH+CH3COONaΘΜ
(3)AΘ°”ΠΫΪ…ζ≥…ΒΡDάδΡΐΒΫΉΑ”–±ΞΚΆΧΦΥαΡΤ»ή“ΚΒΡ ‘ΙήάοΘ§“‘≥ΐ»ΞD÷–…ΌΝΩΒΡ‘”÷ Θ§A≤Μ’ΐ»ΖΘΜ
BΘ°Ζ¥”ΠΔήΈΣ““¥Φ”κ““ΥαΖΔ…ζθΞΜ·Ζ¥”Π…ζ≥…““Υα““θΞΚΆΥ°Θ§¥ΥΖ¥”Π“≤ τ”Ύ»Γ¥ζΖ¥”ΠΘ§B’ΐ»ΖΘΜ
CΘ°œύΆ§Έο÷ ΒΡΝΩΒΡAΓΔB»Φ…’ΚΡ―θΝΩœύΆ§Θ§ΒΪ”κC≥δΖ÷»Φ…’ ±ΚΡ―θΝΩ≤ΜΆ§Θ§C≤Μ’ΐ»ΖΘΜ
DΘ°ΤœΧ―Χ«‘Ύ“ΜΕ®ΧθΦΰœ¬Ζ÷ΫβΩ…“‘…ζ≥…““¥ΦΚΆΕΰ―θΜ·ΧΦΘ§D’ΐ»ΖΘΜ
Ι ―ΓACΓΘ¥πΑΗΈΣΘΚACΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩAΓΔBΓΔCΓΔDΈΣ«ΑΥΡ÷ήΤΎ‘ΣΥΊΘ°A‘ΣΥΊΒΡ‘≠Ή”ΦέΒγΉ”≈≈≤ΦΈΣ![]() Θ§B‘ΣΥΊΒΡΉνΆβ≤ψΒγΉ” ΐ «ΤδΒγΉ”≤ψ ΐΒΡ3±ΕΘ§C‘ΣΥΊ‘≠Ή”ΒΡMΒγΉ”≤ψΒΡPΙλΒά÷–”–3ΗωΈ¥≥…Ε‘ΒγΉ”Θ§D‘ΣΥΊ‘≠Ή”ΚΥΆβΒΡM≤ψ÷–÷Μ”–2Ε‘≥…Ε‘ΒγΉ”ΓΘ
Θ§B‘ΣΥΊΒΡΉνΆβ≤ψΒγΉ” ΐ «ΤδΒγΉ”≤ψ ΐΒΡ3±ΕΘ§C‘ΣΥΊ‘≠Ή”ΒΡMΒγΉ”≤ψΒΡPΙλΒά÷–”–3ΗωΈ¥≥…Ε‘ΒγΉ”Θ§D‘ΣΥΊ‘≠Ή”ΚΥΆβΒΡM≤ψ÷–÷Μ”–2Ε‘≥…Ε‘ΒγΉ”ΓΘ
![]() Β±
Β±![]() ±Θ§
±Θ§![]() τ”Ύ ______ Ζ÷Ή”
τ”Ύ ______ Ζ÷Ή”![]() ΧνΓΑΦΪ–‘Γ±ΜρΓΑΖ«ΦΪ–‘Γ±
ΧνΓΑΦΪ–‘Γ±ΜρΓΑΖ«ΦΪ–‘Γ±![]() Θ°
Θ°
![]() Β±
Β±![]() ±Θ§A”κB–Έ≥…ΒΡΨßΧε τ”Ύ ______ ΨßΧεΘ°
±Θ§A”κB–Έ≥…ΒΡΨßΧε τ”Ύ ______ ΨßΧεΘ°
![]() »τA‘ΣΥΊΒΡ‘≠Ή”ΦέΒγΉ”≈≈≤ΦΈΣ
»τA‘ΣΥΊΒΡ‘≠Ή”ΦέΒγΉ”≈≈≤ΦΈΣ![]() Θ§AΓΔCΓΔD»ΐ÷÷‘ΣΥΊΒΡΒΎ“ΜΒγάκΡή”…¥σΒΫ–ΓΒΡΥ≥–ρ « ______
Θ§AΓΔCΓΔD»ΐ÷÷‘ΣΥΊΒΡΒΎ“ΜΒγάκΡή”…¥σΒΫ–ΓΒΡΥ≥–ρ « ______ ![]() ”Ο‘ΣΥΊΖϊΚ≈±μ Ψ
”Ο‘ΣΥΊΖϊΚ≈±μ Ψ![]() ΓΘ
ΓΘ
![]() “―÷ΣΡ≥ΚλΉœ…Ϊ≈δΚœΈοΒΡΉι≥…ΈΣ
“―÷ΣΡ≥ΚλΉœ…Ϊ≈δΚœΈοΒΡΉι≥…ΈΣ![]() ΗΟ≈δΚœΈο÷–ΒΡ÷––ΡάκΉ”νήάκΉ”‘ΎΜυΧ§ ±ΚΥΆβΒγΉ”≈≈≤Φ ΫΈΣ ______ Θ§”÷“―÷Σ÷––ΡάκΉ”νήάκΉ”ΒΡ≈δΈΜ ΐ «6Θ§1molΗΟΈο÷ ”κΉψΝΩΒΡœθΥα“χΖ¥”ΠΩ……ζ≥…3molAgClΘ§‘ρΗΟΈο÷ Μ·―ß Ϋ « ______ ΓΘ
ΗΟ≈δΚœΈο÷–ΒΡ÷––ΡάκΉ”νήάκΉ”‘ΎΜυΧ§ ±ΚΥΆβΒγΉ”≈≈≤Φ ΫΈΣ ______ Θ§”÷“―÷Σ÷––ΡάκΉ”νήάκΉ”ΒΡ≈δΈΜ ΐ «6Θ§1molΗΟΈο÷ ”κΉψΝΩΒΡœθΥα“χΖ¥”ΠΩ……ζ≥…3molAgClΘ§‘ρΗΟΈο÷ Μ·―ß Ϋ « ______ ΓΘ
![]() Ϋπ τΧζΒΡΨßΧε‘Ύ≤ΜΆ§Έ¬Ε»œ¬”–ΝΫ÷÷Ε―ΜΐΖΫ ΫΘ§ΨßΑϊΖ÷±π»γΆΦΥυ ΨΘ°Χε–ΡΝΔΖΫΨßΑϊΚΆΟφ–ΡΝΔΖΫΨßΑϊ÷– ΒΦ Κ§”–ΒΡFe‘≠Ή”Ηω ΐ÷°±»ΈΣ ______ ΓΘ
Ϋπ τΧζΒΡΨßΧε‘Ύ≤ΜΆ§Έ¬Ε»œ¬”–ΝΫ÷÷Ε―ΜΐΖΫ ΫΘ§ΨßΑϊΖ÷±π»γΆΦΥυ ΨΘ°Χε–ΡΝΔΖΫΨßΑϊΚΆΟφ–ΡΝΔΖΫΨßΑϊ÷– ΒΦ Κ§”–ΒΡFe‘≠Ή”Ηω ΐ÷°±»ΈΣ ______ ΓΘ

≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΖ¥”ΠΘΚ2A(g)+3B(g)![]() C(g)+4D(g)Θ§ΥΌ¬ ΉνΩλΒΡ «(ΓΓ)
C(g)+4D(g)Θ§ΥΌ¬ ΉνΩλΒΡ «(ΓΓ)
A. v(C)=0.1molΓΛL-1ΓΛs-1 B. v(B)=4.0 molΓΛL-1ΓΛmin-1
C. v(A)=2.0molΓΛL-1ΓΛmin-1 D. v(D)=0.3molΓΛL-1ΓΛs-1
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣCH4(g)+2O2(g)ΓζCO2(g)+2H2O(g) ΠΛH== - Q1 ΘΜ
2H2(g)+O2(g) Γζ2H2O(g) ΠΛH== - Q2ΘΜ
H2O(g) ΓζH2O(l) ΠΛH== - Q3
≥ΘΈ¬œ¬Θ§»ΓΧεΜΐ±»ΈΣ4ΘΚ1ΒΡΦΉΆιΚΆH2ΒΡΜλΚœΤχΧε112LΘ®±ξΉΦΉ¥Ωωœ¬Θ©Θ§Ψ≠Άξ»Ϊ»Φ…’ΚσΜ÷Η¥ΒΫ≥ΘΈ¬Θ§‘ρΖ≈≥ωΒΡ»»ΝΩΈΣ
A.4Q1+0.5Q2B.4Q1+Q2+10Q3C.4Q1+2Q2D.4Q1+0.5Q2+9Q3
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΙΛ“ΒΖœΤχΓΔΤϊ≥ΒΈ≤Τχ≈≈Ζ≈≥ωΒΡSO2ΓΔNOxΒ»Θ§ «–Έ≥…Έμω≤ΒΡ÷Ί“Σ“ρΥΊΘ°ω≤ «”…Ω’Τχ÷–ΒΡΜ“≥ΨΓΔΝρΥαΓΔœθΥαΓΔ”–ΜζΧΦ«βΜ·ΚœΈοΒ»ΝΘΉ”–Έ≥…ΒΡ―ΧΈμΘ°
Θ®1Θ©¥σΤχ÷–ΒΡSO2‘Ύ―Χ≥ΨΒΡ¥ΏΜ·œ¬–Έ≥…ΝρΥαΒΡΖ¥”ΠΖΫ≥Χ Ϋ «_____ΘΜ
Θ®2Θ©“―÷Σ2SO2Θ®gΘ©+O2Θ®gΘ©![]() 2SO3Θ®gΘ©ΓςH=©¹196kJ/molΘ§ΧαΗΏΖ¥”Π÷–SO2ΒΡΉΣΜ·¬ Θ§ «Φθ…ΌSO2≈≈Ζ≈ΒΡ”––ß¥κ ©Θ°
2SO3Θ®gΘ©ΓςH=©¹196kJ/molΘ§ΧαΗΏΖ¥”Π÷–SO2ΒΡΉΣΜ·¬ Θ§ «Φθ…ΌSO2≈≈Ζ≈ΒΡ”––ß¥κ ©Θ°
ΔΌTΈ¬Ε» ±Θ§‘Ύ2L»ίΜΐΙΧΕ®≤Μ±δΒΡΟή±’»ίΤς÷–Φ”»κ2.0molSO2ΚΆ1.0molO2Θ§5minΚσΖ¥”Π¥οΒΫΤΫΚβΘ§Εΰ―θΜ·ΝρΒΡΉΣΜ·¬ ΈΣ50%Θ§‘ρΠ‘Θ®O2Θ©=___ ΘΜ
ΔΎ‘ΎΔΌΒΡΧθΦΰœ¬Θ§≈–ΕœΗΟΖ¥”Π¥οΒΫΤΫΚβΉ¥Χ§ΒΡ±ξ÷Ψ «____Θ®ΧνΉ÷ΡΗΘ©Θ°
aΘ°SO2ΓΔO2ΓΔSO3»ΐ’ΏΒΡ≈®Ε»÷°±»ΈΣ2ΘΚ1ΘΚ2
bΘ°»ίΤςΡΎΤχΧεΒΡ―Ι«Ω≤Μ±δ
cΘ°»ίΤςΡΎΜλΚœΤχΧεΒΡΟήΕ»±Θ≥÷≤Μ±δ
dΘ°SO3ΒΡΈο÷ ΒΡΝΩ≤Μ‘Ό±δΜ·
eΘ°SO2ΒΡ…ζ≥…ΥΌ¬ ΚΆSO3ΒΡ…ζ≥…ΥΌ¬ œύΒ»
Θ®3Θ©―ΧΤχ÷–ΒΡSO2Ω…“‘”ΟNaOH»ή“ΚΈϋ ’Θ§ΫΪΥυΒΟΒΡNa2SO3»ή“ΚΫχ––ΒγΫβΘ§Ω…―≠ΜΖ‘Ό…ζNaOHΘ§Ά§ ±ΒΟΒΫH2SO4Θ§Τδ‘≠άμ»γΆΦΥυ ΨΘ°Θ®ΒγΦΪ≤ΡΝœΈΣ ·ΡΪΘ©
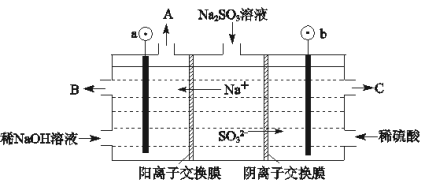
ΔΌΆΦ÷–aΦΪ“ΣΝ§Ϋ”Βγ‘¥ΒΡΘ®ΧνΓΑ’ΐΓ±ΜρΓΑΗΚΓ±Θ©____ ΦΪΘ§CΩΎΝς≥ωΒΡΈο÷ «____ΘΜ
ΔΎSO32©¹Ζ≈ΒγΒΡΒγΦΪΖ¥”Π ΫΈΣ _________ ΘΜ
ΔέΒγΫβΙΐ≥Χ÷–»τœϊΚΡ12.6g Na2SO3Θ§‘ρ“θΦΪ«χ±δΜ·ΒΡ÷ ΝΩΈΣ _________ gΘ®ΦΌ…ηΗΟΙΐ≥Χ÷–Υυ”–“ΚΧεΫχ≥ωΩΎΟή±’Θ©ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“ΜΕ®Έ¬Ε»œ¬Θ§‘ΎΚψ»ίΟή±’»ίΤς÷–ΖΔ…ζΩ…ΡφΖ¥”Π:X2(g)+Y2(g)![]() 2Z(g)Θ§“―÷ΣX2ΓΔY2ΓΔZΒΡΤπ Φ≈®Ε»Ζ÷±πΈΣ0.lmol/LΓΔ0.3mol/LΓΔ0.2mol/LΘ§Β±Ζ¥”Π¥οΒΫΤΫΚβ ±Θ§ΗςΈο÷ ΒΡ≈®Ε»Ω…Ρή «
2Z(g)Θ§“―÷ΣX2ΓΔY2ΓΔZΒΡΤπ Φ≈®Ε»Ζ÷±πΈΣ0.lmol/LΓΔ0.3mol/LΓΔ0.2mol/LΘ§Β±Ζ¥”Π¥οΒΫΤΫΚβ ±Θ§ΗςΈο÷ ΒΡ≈®Ε»Ω…Ρή «
A. c(X2)=0.2mol/L B. c(Y2)=0.4mol/L
C. c(Z)=0.3mol/L D. c(X2)+c(Y2)+c(Z)=0.5mol/L
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈ§…ζΥΊPΒΡΫαΙΙ»γΆΦΥυ ΨΘ§Τδ÷–RΈΣΆιΧΰΜυΓΘœ¬Ν–ΙΊ”ΎΈ§…ζΥΊPΒΡ–π ω’ΐ»ΖΒΡ «
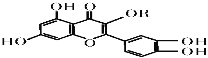
A.Ζ÷Ή”÷–ΒΡΙΌΡήΆ≈”–τ«ΜυΓΔΧΦΧΦΥΪΦϋΓΔΟ―ΦϋΓΔθΞΜυ
B.»τRΈΣΦΉΜυΘ§‘ρΗΟΈο÷ ΒΡΖ÷Ή” ΫΩ…“‘±μ ΨΈΣC16H12O7
C.1 molΗΟΜ·ΚœΈοΉνΕύΩ…œϊΚΡNaOH ΈΣ5mol
D.1 molΗΟΜ·ΚœΈοΉνΕύœϊΚΡδεΥ°÷–ΒΡδε5 mol
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΧζΒΡΡ≥÷÷―θΜ·Έο20 gΘ§‘ΎΦ”»»ΒΡΧθΦΰœ¬Ά®»κΉψΝΩΒΡCOΆξ»ΪΖ¥”ΠΘ§ΫΪ…ζ≥…ΒΡΤχΧε”Ο ·Μ“Υ°Έϋ ’Θ§ΒΟΒΫ≥ΝΒμ37.5 gΘ§«σΗΟ―θΜ·Έο÷–Χζ‘ΣΥΊ”κ―θ‘ΣΥΊΒΡ÷ ΝΩ±»ΓΘ_________
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΥ° «…ζΟϋ÷°‘¥Θ§”κΈ“Ο«ΒΡ…ζΜνΟή«–œύΙΊΓΘ‘ΎΜ·―ß Β―ιΚΆΩΤ―ß―–ΨΩ÷–Θ§Υ°“≤ «“Μ÷÷≥Θ”ΟΒΡ ‘ΦΝΓΘ
(1)H2OΥ°Ζ÷Ή”ΒΡVSEPRΡΘ–ΆΈΣ_______–ΈΘ§―θ‘≠Ή”ΒΡ‘”Μ·ΖΫ ΫΈΣ_____
(2)Υ°Ζ÷Ή”‘ΎΧΊΕ®ΧθΦΰœ¬»ί“ΉΒΟΒΫ“ΜΗωHΘΪΘ§–Έ≥…Υ°Κœ«βάκΉ”(H3OΘΪ)Θ§”ΟΒγΉ” Ϋ±μ ΨΥϋΒΡ–Έ≥…Ιΐ≥ΧΈΣ___________________________Θ§
(3)Ε‘”Ύ(2)÷–…φΦΑΒΡ±δΜ·Ιΐ≥ΧΒΡΟη ω≤ΜΚœάμΒΡ «________ΓΘ
aΘ°―θ‘≠Ή”ΒΡ‘”Μ·άύ–ΆΖΔ…ζΝΥΗΡ±δ bΘ°ΈΔΝΘΒΡ–ΈΉ¥ΖΔ…ζΝΥΗΡ±δ
cΘ°ΈΔΝΘΒΡΜ·―ß–‘÷ ΖΔ…ζΝΥΗΡ±δ dΘ°ΈΔΝΘ÷–ΒΡΦϋΫ«ΖΔ…ζΝΥΗΡ±δ
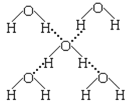
(4)‘Ύ±υΨßΧε÷–Θ§ΟΩΗωΥ°Ζ÷Ή””κœύΝΎΒΡ4ΗωΥ°Ζ÷Ή”–Έ≥…«βΦϋ(»γΆΦΥυ Ψ)Θ§“―÷Σ±υΒΡ…ΐΜΣ»» «51 kJ/molΘ§≥ΐ«βΦϋΆβΘ§Υ°Ζ÷Ή”ΦδΜΙ¥φ‘ΎΖΕΒ¬ΜΣΝΠ(11 kJ/mol)Θ§‘ρ±υΨßΧε÷–«βΦϋΒΡΓΑΦϋΡήΓ± «_________kJ/mol(…ηΤχΧ§Υ°÷–Έό«βΦϋ)ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com