
在容积为VL的密闭容器中放入2LA和1LB,3A(g)+B(g)  nC(g)+2D(g),达到平衡后,A物质的量减少1/2,混合气体的平均摩尔质量增大1/8,则该反应中n的值( )
nC(g)+2D(g),达到平衡后,A物质的量减少1/2,混合气体的平均摩尔质量增大1/8,则该反应中n的值( )
| A. 1 | B. 2 | C. 3 | D. 4 |
科目:高中化学 来源: 题型:计算题
工业合成氨的反应为:N2(g)+3H2(g) 2NH3(g) △H <0
2NH3(g) △H <0
某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。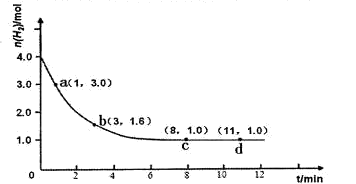
(1)反应开始3min内,H2的平均反应速率为 。
(2)计算该条件下合成氨反应的化学平衡常数(写出计算过程,结果保留2位有效数字)。
(3)仅改变温度为T2 ( T2小于TI)再进行实验,请在答题卡框图中画出H2的物质的量随反应时间变化的预期结果示意图。
(4)在以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C+H2O(g)  CO+H2;②CO+H2O(g)
CO+H2;②CO+H2O(g)  CO2+H2;
CO2+H2;
已知:CO(g)+1/2O2(g)=CO2(g) △H=—283.0kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H=—241.8kJ/mol
写出上述CO与H2O(g)反应的热化学方程式: 。
(5)合成氨工业中,原料气(N2、H2混有少量CO、NH3)在进入合成塔之前,用醋酸二氨合铜(I)溶液来吸收CO,其反应为:
CH3COO[Cu(NH3)2]+CO+NH3 CH3COO[Cu(NH3)3]?CO △H<0
CH3COO[Cu(NH3)3]?CO △H<0
写出提高CO吸收率的其中一项措施: 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在下列影响化学反应速率的因素中,能使化学反应速率加快的方法是( )
①升高温度 ②加入催化剂 ③增大反应物浓度④将块状固体反应物磨成粉末
| A.①②③ | B.①②④ | C.①③④ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定温度下的恒容密闭容器中,能说明反应X2(g)+ Y2(g) 2XY(g) 已达到平衡的是( )
2XY(g) 已达到平衡的是( )
| A.容器中的总压不随时间变化 |
| B.容器中的气体平均相对分子质量不随时间变化 |
| C.容器中的混合气体的密度不随时间变化 |
| D.容器中的各种气体的质量分数不随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应A(s)+2B(g)  C(g)+D(g)已达到平衡状态①各气体物质的物质的量浓度②气体的总物质的量③混合气体的压强④混合气体的密度
C(g)+D(g)已达到平衡状态①各气体物质的物质的量浓度②气体的总物质的量③混合气体的压强④混合气体的密度
| A.只有①② | B.只有①④ | C.只有①③④ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为了说明影响化学反应快慢的因素,甲、乙、丙、丁4位同学分别设计了如下4个实验,你认为结论不正确的是( )
| A.将形状、大小均相同的镁条和铝条与相同浓度的盐酸反应时,两者速率一样 |
| B.在相同条件下,等质量的大理石块和大理石粉末与相同浓度的盐酸反应,大理石粉末反应快 |
| C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 |
| D.两只试管中分别加入相同质量的氯酸钾,其中一只试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
保持相同的温度,可逆反应 2A (g) + B(g)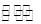 2C(g)在1×105 Pa和1×106 Pa条件下分 别达到平衡时的逆反应速率,后者与前者相比较( )
2C(g)在1×105 Pa和1×106 Pa条件下分 别达到平衡时的逆反应速率,后者与前者相比较( )
| A.大于 | B.小于 | C.等于 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:
2X(g)+Y(g)  Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是( )
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是( )
| A.60 s内X的平均反应速率为0.001 mol·L-1·s-1 |
| B.将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的1/2 |
| C.若温度和体积不变,往容器内增加1 mol X,Y的转化率将增大 |
| D.若升高温度,X的体积分数增大,则正反应的△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com