
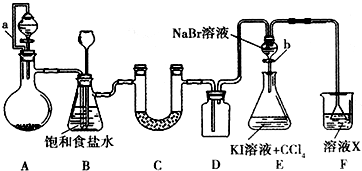
 某同学设计如图所示的实验方案,请回答下列问题.
某同学设计如图所示的实验方案,请回答下列问题.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:

|

| 通电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
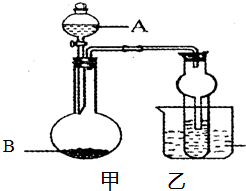 某同学设计如图所示的装置进行实验,请回答:
某同学设计如图所示的装置进行实验,请回答:| 编号 | 液体A | 固体B | 可制得的气体 |
| ① | 浓氨水 | NaOH | NH3 |
| ② | 稀硫酸 | Zn | H2 |
| ③ | 稀盐酸 | CaC03 | C02 |
| ④ | 双氧水 | Mn02 | Q |
| ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
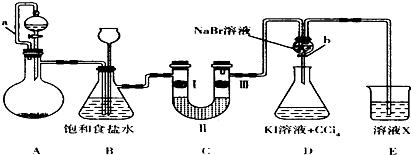
| ① | ② | ③ | ④ | |
| I | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| II | 碱石灰 | 氯化钙 | 硅胶 | 氯化钠 |
| III | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)装置B的作用是________________________。
(2)三个装置之间的连接顺序是(填写导管口序号a、b、c、d、e、f):气体发生装置导管口接____________,然后____________接____________,____________接____________。
(3)装置A、B、C中各有什么现象?
A中_____________________,B中_____________________,C中_____________________。
(4)乙醇与浓硫酸反应的装置与制取____________气体的装置相同。
(5)为了防止制得气体不纯,是否可以把温度控制在较低(140 ℃)情况下进行反应?为什么?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com