
| A、16O2与18O2互为同素异形体 |
| B、16O与18O核外电子排布方式不同 |
| C、通过化学变化可以实现16O与18O间的相互转化 |
| D、16O与18O是氧元素的两种核素 |


科目:高中化学 来源: 题型:
| A、在硫化钠溶液中加入足量稀硝酸:S2-+2H+=H2S↑ | ||||
| B、往氯化铁溶液中通入硫化氢气体:2Fe3++S2-=2Fe2++S↓ | ||||
C、用惰性电极电解饱和食盐水:2Cl-+2H2O
| ||||
D、乙醛的银镜反应:CH3CHO+2Ag(NH3)2OH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
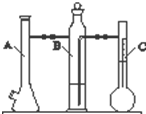 利用如图所示实验装置可以测定一定条件下1mol气体的体积.图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的稀硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.
利用如图所示实验装置可以测定一定条件下1mol气体的体积.图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的稀硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.| 实验 次数 | m(Mg)/g | 硫酸体 积/mL | 液体量瓶中 液体体积/mL | 抽出气体 体积/mL | 氢气体 积/mL | 计算1mol 氢气体积/L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | x | |
| 2 | 0.115 | 10.0 | 121.0 | 8.0 |
| 实验值-理论值 |
| 理论值 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
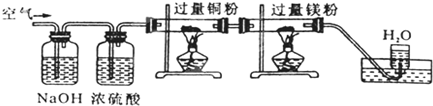
| A、CO2、H2O、O2、N2 |
| B、N2、O2、CO2、H2O |
| C、H2O、CO2、N2、O2 |
| D、CO2、N2、H2O、O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com