
| ||
| ag |
| 700(W2-W1) |
| a |
| 700(W2-W1) |
| a |


科目:高中化学 来源: 题型:
| A、1molNaOH的摩尔质量为40g |
| B、1mol 物质含有的微粒数就是6.02×1023 |
| C、1molN2的体积为22.4L |
| D、0.5molCO2约含有3.01×1023个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④⑤⑥ | B、②④⑤⑥ |
| C、②④⑤ | D、②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
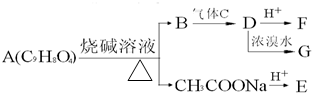 A为药用有机物,从A出发可发生如图所示的一系列反应.已知A在一定条件下能与醇发生酯化反应,A分子中的苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应.请回答下列问题:
A为药用有机物,从A出发可发生如图所示的一系列反应.已知A在一定条件下能与醇发生酯化反应,A分子中的苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
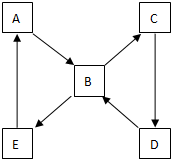 如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).单质A能与某气态单质化合生成化合物B.
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).单质A能与某气态单质化合生成化合物B.查看答案和解析>>
科目:高中化学 来源: 题型:
| 水 |
| 酒化酶 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16O2与18O2互为同素异形体 |
| B、16O与18O核外电子排布方式不同 |
| C、通过化学变化可以实现16O与18O间的相互转化 |
| D、16O与18O是氧元素的两种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
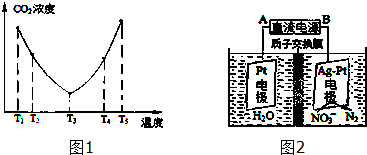
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com