
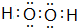 ����������ԭ�ӵ��ӻ���ʽΪsp3��
����������ԭ�ӵ��ӻ���ʽΪsp3������ A��B��C��D��E����Ԫ�ص�ԭ��������������A�Ƕ������������������������ķǽ���Ԫ�أ���AΪHԪ�أ�BԪ�ص�ԭ�ӼȲ���ʧȥҲ���õ����ӣ����̬ԭ����ÿ���ܼ���������ͬ����BΪ̼Ԫ�أ�C Ԫ�صļ۵��ӹ���Ϊnsnnpn+1������s�ܼ��������2�����ӣ���p�ܼ����ɵ��ӣ���n=2����CΪNԪ�أ�D ����������������Ӳ���֮��Ϊ3��1��ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����DΪOԪ�أ�EԪ�����ҹ�����ʹ�õĺϽ����Ҫ�ɷ�Ԫ�أ���EΪCu���ݴ˽��
��� �⣺A��B��C��D��E����Ԫ�ص�ԭ��������������A�Ƕ������������������������ķǽ���Ԫ�أ���AΪHԪ�أ�BԪ�ص�ԭ�ӼȲ���ʧȥҲ���õ����ӣ����̬ԭ����ÿ���ܼ���������ͬ����BΪ̼Ԫ�أ�C Ԫ�صļ۵��ӹ���Ϊnsnnpn+1������s�ܼ��������2�����ӣ���p�ܼ����ɵ��ӣ���n=2����CΪNԪ�أ�D ����������������Ӳ���֮��Ϊ3��1��ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����DΪOԪ�أ�EԪ�����ҹ�����ʹ�õĺϽ����Ҫ�ɷ�Ԫ�أ���EΪCu��
��1��EΪCuԪ�أ��۵����Ų�ʽΪ3d104s1����Ԫ�����ڱ��е�λ�ã���4����IB�壬
�ʴ�Ϊ����4����IB�壻3d104s1��
��2��A�ֱ���B��C��D���γɵ�������Ϊ10�Ļ�����ֱ�ΪCH4��NH3��H2O��������ˮΪҺ̬����������Ϊ���壬��ˮ�ķе���ߣ�����������֮�����������е���ڼ���ģ������ǵķе��ɸߵ��͵�˳����H2O��NH3��CH4��
�ʴ�Ϊ��H2O��NH3��CH4��
��3��A��D�γɵĺ��зǼ��Լ��ķ���ΪH2O2������ʽΪ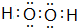 ��������Oԭ���γ�2���� ��������2�Թ¶Ե��ӣ��ӻ������ĿΪ4��Oԭ�ӵ��ӻ���ʽΪsp3��
��������Oԭ���γ�2���� ��������2�Թ¶Ե��ӣ��ӻ������ĿΪ4��Oԭ�ӵ��ӻ���ʽΪsp3��
�ʴ�Ϊ��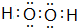 ��sp3��
��sp3��
��4��ͬ������ԭ����������һ�����ܳ��������ƣ���Nԭ��2P�ܼ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ�����ܣ�N��O��C��
�ʴ�Ϊ��N��O��C��
��5������H��N��O����Ԫ�صĻ������ж��֣������£�ˮ��ҺPH��7��������ˮ��������������NH3•H2O��ˮ��ҺPH��7���ܴٽ�ˮ�����ǿ�������NH4NO3���������ֻ����ﰴ���ʵ���֮��1��1�����ˮ�У�����ˮ��ҺpH=10����Һ�ʼ��ԣ�˵��һˮ�ϰ��ĵ���̶ȴ���笠����ӵ�ˮ��̶ȣ�����Һ������Ũ���ɴ�С��˳��Ϊ��c��NH4+����c��NO3-����c��OH-����c��H+����
�ʴ�Ϊ��NH3•H2O��NH4NO3��c��NH4+����c��NO3-����c��OH-����c��H+����
��6����֪��25�桢101kPa �£�HCN��aq��+H2O��1���TCN-��aq��+H3 O+��aq����H=+45.6kJ•mol-1
H3 O+��aq��+OH-��aq���T2H2O��1����H=-57.3kJ•mol-1
���Ȼ�ѧ����ʽ��ӿɵã�HCN��aq��+OH-��aq���TCN-��aq��+H2O��1����H=-11.7kJ•mol-1
�ʴ�Ϊ��HCN��aq��+OH-��aq���TCN-��aq��+H2O��1����H=-11.7kJ•mol-1��
���� ���⿼��ṹ����λ�ù�ϵ�ۺϿ��飬�ƶ�Ԫ���ǽ���ؼ���ע����������ͬ���ڵ�һ�������쳣ԭ�������������ø�˹���ɽ����Ȼ�ѧ����ʽ��д����Ӧ�ȼ���ȣ��Ѷ��еȣ�


 ��У���һ��ͨϵ�д�
��У���һ��ͨϵ�д� �γ̴����Ծ�����100��ϵ�д�
�γ̴����Ծ�����100��ϵ�д� �¾�����ĩ���100��ϵ�д�
�¾�����ĩ���100��ϵ�д� ȫ�ܴ���100��ϵ�д�
ȫ�ܴ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ���� | �����£��Թ��������Լ���������/mL | ��������Һ��ɫ������ɫ����ʱ��/min | |||
| 0.6 mol/L H2C2O4��Һ | H2O | 0.2 mol/L KMnO4��Һ | 3 mol/L ϡ���� | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 2.0 | 3.0 | 3.0 | 2.0 | 5.2 |
| 3 | 1.0 | 4.0 | 3.0 | 2.0 | 6.4 |
| ʵ���� | �����£��Թ��������Լ���������/mL | �����Թ��м����������� | ��������Һ��ɫ������ɫ����ʱ��/min | |||
| 0.6 mol/L H2C2O4��Һ | H2O | 0.2 mol/L KMnO4��Һ | 3 mol/L ϡ���� | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��t2��ʱ��MgSO4������Һ���¶����ߣ���Һ��Ȼ���� | |
| B�� | ��t3��ʱ��MgSO4������Һ���¶Ƚ��ͣ��о������� | |
| C�� | t2��ʱ��������Һ���������ʵ���Ũ�ȣ�MgSO4��NaCl�� | |
| D�� | �ֱ�t1��ʱMgSO4������Һ��NaCl������Һ���¶����ߵ�t2�棬������Һ��������������ǰ�߸��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{r��Ca��}{r��Mg��}$ | B�� | $\frac{r��C{l}^{-}��}{r��A{l}^{3+}��}$ | C�� | $\frac{r��Na��}{r��Mg��}$ | D�� | $\frac{r��N{a}^{+}��}{r��{F}^{-}��}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������������;���ĺϽ𣬸����仯ѧ�ɷֿɷ�Ϊ��̼�ֺ͵�̼�������� | |
| B�� | ������������������Ҫ�Ĵ�����Ⱦ�������ֱ��Σ�����彡�������γ����꣬�����PHֵͨ��С��6.5 | |
| C�� | ���Ǻ͵����ʶ������������������Ҫ���õĸ߷��ӻ�������ǵ�ˮ����ﶼ�������������� | |
| D�� | �ϳɸ߷��Ӳ������ִ������з����ż�������ã��۱���ϩ����ȩ��֬�����ڡ�˳�������ɵ��������γɵ����߷��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
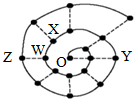 ijͬѧ���о�ǰ18��Ԫ��ʱ���֣����Խ������ų�����ͼ��ʾ�ġ���ţ����״��ͼ��ÿ����•������һ��Ԫ�أ�����O�㣨�����ĵĵ㣩�������Ԫ�أ�����˵������ȷ���ǣ�������
ijͬѧ���о�ǰ18��Ԫ��ʱ���֣����Խ������ų�����ͼ��ʾ�ġ���ţ����״��ͼ��ÿ����•������һ��Ԫ�أ�����O�㣨�����ĵĵ㣩�������Ԫ�أ�����˵������ȷ���ǣ�������| A�� | ����YO���ܾ��н�ǿ�������� | |
| B�� | ͼ����O��ԽԶ��Ԫ�أ���ԭ�Ӱ뾶һ��Խ�� | |
| C�� | O2X��WO3�����ڶ�������������Էе㶼�ϸ� | |
| D�� | ��ѧ�ҷ���һ����ϸ����DNA�������飨As��Ԫ�أ���AsԪ�����п���ȡ������ͨDNA���е�ZԪ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Ԫ�� | �����Ϣ |
| A | �ڳ��¡���ѹ�£��䵥�������壬��������Ի�������ʶ��Ҫ�����ߣ�������Ϊ�������������ȼ�� |
| B | ��ҵ��ͨ������Һ̬��������䵥�ʣ���ij��ͬ���������DZ�������ر���������Ҫ���� |
| C | ֲ��������Ҫ��֮һ�������γɶ������������һ��������ҽ����ʹ�õ������� |
| D | �������䵥��Ϊ����ɫ��ĩ״���壬�������ۻ����õ�����������ȼ�գ���������������ɫ���� |
| E | ���ڵؿ��д����ḻ�������岻��ȱ�ٵ���Ԫ��֮һ���䵥��Ϊ����ɫ���壬�ǹ�ũҵ�����в��ɻ�ȱ�Ľ������ϣ������ڻ�е�Ʊ�����������ҵ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2H2��g��+O2��g���T2H2O��g����H=+483.6 kJ/mol | |
| B�� | ��֪C��ʯī��s��=C�����ʯ��s����H��0������ʯ��ʯī�ȶ� | |
| C�� | ��20.0 g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7kJ�����������ʾ�÷�Ӧ���Ȼ�ѧ����ʽΪ��NaOH��aq��+HCl��aq���TNaCl��aq��+H2O��l����H=-57.4 kJ/mol | |
| D�� | ��֪2C��s��+2O2��g���T2CO2��g����H1��2C��s��+O2��g���T2CO��g����H2�����H1����H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
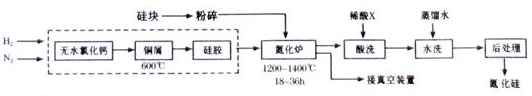
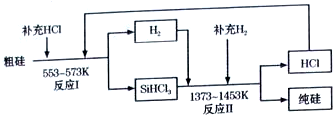
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com