
| A. | 2H2(g)+O2(g)═2H2O(g)△H=+483.6 kJ/mol | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol | |
| D. | 己知2C(s)+2O2(g)═2CO2(g)△H1 2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
分析 A、氢气在氧气中燃烧是放热反应,所以△H<0;
B、能量越高越不稳定,而C(石墨,s)=C(金刚石,s)△H>0,所以金刚石的能量高,金刚石不稳定;
C、中和热是指强酸强碱稀溶液恰好中和反应生成1mol水放出的热量;
D、根据盖斯定律可得:2CO(g)+O2(g)=2CO2(g)△H=△H1-△H2,CO燃烧为放热反应.
解答 解:A、氢气在氧气中燃烧是放热反应,所以△H<0,故A错误;
B、能量越高越不稳定,而C(石墨,s)=C(金刚石,s)△H>0,所以金刚石的能量高,金刚石不稳定,所以石墨比金刚石稳定,故B错误;
C、含20.0g NaOH物质的量为0.5mol,稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,所以中和热为-57.4KJ/mol,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.4 kJ/mol,故C正确;
D.根据盖斯定律可得:2CO(g)+O2(g)=2CO2(g)△H=△H1-△H2,CO燃烧为放热反应,即△H1-△H2<0,则△H1<△H2,故D错误,
故选C.
点评 本题考查热化学方程式、燃烧热、中和热、反应热大小比较等,难度不大,注意对概念的理解、盖斯定律的应用,


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
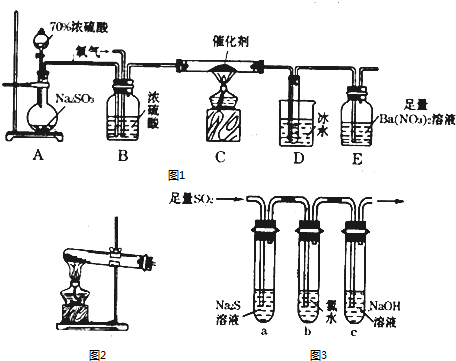
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
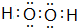 ,其中中心原子的杂化方式为sp3.
,其中中心原子的杂化方式为sp3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水 | B. | AgNO3 | C. | NaOH | D. | BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cu2+、NO3-、SO42-- | B. | K+、Na+、Cl-、SiO32- | ||
| C. | Al3+、NH4+、NO3-、Cl- | D. | K+、Na+、AlO2-、Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
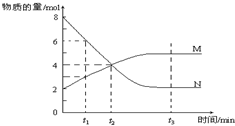
| A. | 该反应的化学方程式为:2 M?N | |
| B. | t1时,V正>V逆 | |
| C. | t2时,V正=V逆,达到平衡 | |
| D. | t 3时,M、N的浓度不再发生变化,反应停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78克苯中含有碳碳双键的数目为3NA | |
| B. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| C. | 标准状况下,2.24LCCl4所含分子数为0.1NA | |
| D. | 0.2mol金属钠与足量的O2反应,产物中离子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  | 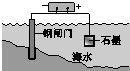 |
| 钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀 | 钢铁表面水膜的酸 性较强,发生析氢 腐蚀 | 将锌板换成铜板对 钢闸门保护效果更好 | 钢闸门作为阴极而受到保护 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com