
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)原子半径最小的元素是___(填元素名称),写出⑥的离子结构示意图___。
(2)③的单质的电子式为__。
(3)以上9种元素中最高价氧化物对应水化物酸性最强的是___(填化学式)。
(4)⑤与⑦形成的化合物中,化学键类型为___。
(5)②与④形成的原子个数比为1:2的化合物的结构式为____。
(6)③、④、⑥的原子半径由大到小的顺序为___(用元素符号回答)。
(7)为探究元素②和⑧的非金属性强弱,某同学设计了如图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。请回答:
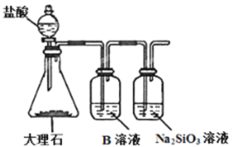
a.溶液B的作用是___。
b.上述实验中,能说明②和⑧非金属性强弱的化学方程式是___。
【答案】氢 ![]()
![]() HClO4 离子键 O=C=O Na>N>O 除去CO2气体中的HCl Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓
HClO4 离子键 O=C=O Na>N>O 除去CO2气体中的HCl Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓
【解析】
根据元素在周期表中的相对位置,①、②、③、④、⑤、⑥、⑦、⑧、⑨代表的元素分别是H、C、N、O、F、Na、Mg、Si、Cl;
(1)电子层数越少,原子半径越小,原子半径最小的元素是氢;⑥是11号元素钠,钠离子核外有10个电子,离子结构示意图是![]() ;
;
(2)③是N元素,N2分子中含有氮氮三键,N2的电子式为![]() ;
;
(3)非金属性越强,最高价氧化物的水化物酸性越强,氟元素没有正价,所以最高价氧化物对应水化物酸性最强的是HClO4;
(4)F与Mg形成离子化合物MgF2,化学键类型为离子键;
(5)C与O形成的原子个数比为1:2的化合物是CO2,结构式为O=C=O。
(6)Na的电子层数最多半径最大,N、O电子层数相同,N质子数大于O,所以原子半径由大到小的顺序为Na>N>O;
(7)根据强酸制弱酸的原理,盐酸和石灰石反应生成二氧化碳,用碳酸氢钠溶液除去氯化氢,通入硅酸钠溶液生成硅酸沉淀,可证明非金属性C大于Si,所以溶液B是碳酸氢钠,作用是除去CO2气体中的HCl;二氧化碳和硅酸钠溶液反应生成硅酸沉淀,能说明非金属性C大于Si,化学方程式是Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓。


科目:高中化学 来源: 题型:
【题目】镁-次氯酸盐电池的工作原理如图,该电池反应为:![]() 。下列有关说法正确的是( )
。下列有关说法正确的是( )
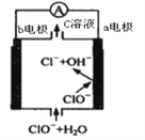
A.电池工作时,正极 a 附近的 pH 将不断增大
B.电池工作时,C溶液中的溶质是![]()
C.负极反应式:![]()
D.a 电极发生还原反应,每转移 0.2mol电子,理论上生成 0.2mol ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(![]() )在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是
)在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是
A. 甲醛分子间可以形成氢键B. 甲醛分子和甲醇分子内C原子均采取sp2杂化。
C. 甲醛为极性分子D. 甲醇的沸点远低于甲醛的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在一定条件下,反应X(g)+3Y(g)![]() 2Z(g) ΔH=-akJ·mol-1(a>0),某实验小组测得X的转化率(α)在不同温度与压强(p)下的实验数据,三者之间关系如图所示。下列说法正确的是( )
2Z(g) ΔH=-akJ·mol-1(a>0),某实验小组测得X的转化率(α)在不同温度与压强(p)下的实验数据,三者之间关系如图所示。下列说法正确的是( )
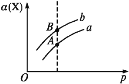
A.图中A、B两点对应的平衡常数相等
B.上述反应在达到平衡后,缩小体积,Y的转化率提高
C.升高温度,正、逆反应速率增大,平衡向正反应方向移动
D.将2.0molX、6.0molY置于密闭容器中发生反应,放出的热量为2akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用不同的实验装置研究苯与液溴的反应并制取少量溴苯。试回答下列问题:


(1)若采用图甲装置进行实验,装置A中应预先需加入的试剂是____,E装置的作用是___。
(2)若采用图乙装置进行实验,C中盛放的CCl4的作用是____________。
(3)若使用图乙装置,实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,然后用___(填仪器名称)分离出溴苯(仍含有少量苯)。写出有关的离子反应方程式__________。
(4)反应完毕后,向试管D中滴加AgNO3溶液,若有_______(填现象)生成,说明这种获得溴苯的反应属于______ (填有机反应类型)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 2L 0.5 mol·L—1的亚硫酸溶液中H+数目为2NA
B. 0.1mol铜与足量浓硝酸反应产生的气体分子数一定为0.2NA个
C. T ℃ 时,1L pH=6的纯水中,含OH—数目为10—8NA个
D. 1L 0.1 mol·L—1的NaHCO3溶液中,HCO3—和CO32—离子数目之和小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法正确的是( )
A. 取等体积、同浓度的醋酸和盐酸溶液与足量Zn反应,产生的氢气量一样多。
B. 用HF溶液做导电性实验,灯泡很暗,则一定说明HF为弱电解质。
C. 稀释醋酸溶液,溶液中所有离子浓度都减少。
D. 氨水稀释时,![]() 不断减少
不断减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾 (K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。湿法制备的主要反应方程为:2Fe(OH)3+3ClO-+4OH-=2FeO42- +3Cl-+5H2O,干法制备的主要反应方程为:2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O +2Na2SO4 +O2↑ 下列有关说法不正确的是
A.低温下,高铁酸钾的溶解度比高铁酸钠更小
B.湿法制备中每生成1mol Na2FeO4 转移3mol电子
C.干法制备中还原剂与氧化剂的物质的量之比为1:3
D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
X | Y | Z | 物质转化关系 | |
A | Cu | CuO | Cu(OH)2 |
|
B | Si | SiO2 | H2SiO3 | |
C | NaHCO3 | Na2CO3 | NaOH | |
D | FeCl2 | FeO | FeCl3 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com