
����Ŀ��ij��ɫũҩ�ṹ��ʽΪͼ1���ش��������⡣
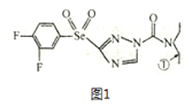
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ______________����ũҩ���Ԫ���У���һ�����ܽϴ��ǰ����Ԫ����______________(���ɴ�С��������)��
��2�������б��Ϊ�ٵ�̼ԭ�Ӻ�����ɼ������⼸��ԭ�ӹ��ɵĿռ�ṹΪ____________��CSe2�״�����H2Se ��CCl4; ��Ӧ��ȡ�ģ��ԱȽ��������ַ��ӵļ���_____________(������С˳������)��
��3��H2SeO3 ���ӵ�����ԭ���ӻ�������____________���ԱȽ�H2SeO3��H2SeO4 ��H2SO4�����������ǿ��(����ǿ����˳������)_______________��
��4��ʯī��̼Ԫ�ص�һ��ͬ�������壬ʯī����ɿ���ABABA...�ѻ���ʽ�������ṹ�Ͳ��־���������ͼ2 ��ʾ; ��������ӿ������ʯī�����γ�ʯī�в㻯���ͬʱ�ѻ���ʽ��ABABAB...��ΪAAAA...��
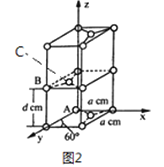
��ԭ����������������Ǿ�����ԭ�Ӽ�����λ�á�ʯī������̼ԭ��A��B ����������ֱ�Ϊ: A��0��0��0)��B(0��1��1/2)����C ԭ�ӵ��������Ϊ_____________����
�ھ���������������Ʒ���Ĵ�С����״����֪ʯī�����ױ߳�Ϊa pm������Ϊd pm�������ӵ�������ֵΪNA����ʯī���ܶ�Ϊ_____________g/cm3 (д������ʽ����)��
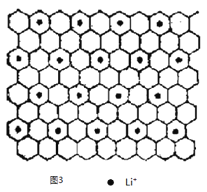
��ͼ3Ϊʯī�в㻯����W ��ͶӰͼ����д��W �Ļ�ѧʽ_____________����֮����ڵĻ�ѧ����_____________��
���𰸡� [Ar] 3d104s24p4 F>N>O �������� Cse2> CCl4> H2Se sp3��sp3 H2SO4> H2SeO4> H2SeO3 (1/3��2/3��1/2) 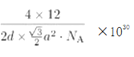 C8Li ���Ӽ����ۼ�
C8Li ���Ӽ����ۼ�
��������������Ҫ�������ʽṹ��
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ[Ar]3d104s24p4����ũҩ���Ԫ���У���һ�����ܽϴ��ǰ����Ԫ����F��C��N��һ��ǽ�����Խǿ����һ������Խ�ǽ����ԣ�F>O>N���������ڵ�ԭ���������Ӵ��ڰ�����Ľ��ȶ�״̬��ʹ�õ��ĵ�һ�����ܴ����������Ե�һ�����ܣ�F>N>O��
��2�������б��Ϊ�ٵ�̼ԭ�Ӻ�����ɼ������⼸��ԭ���γɵ��������ɵĿռ�ṹΪ����������CSe2��CO2�ǵȵ����壬CSe2��ֱ���η��ӣ�������120����H2Se��H2O�ǵȵ����壬H2Se�ļ���С��109.5�㣬CCl4�����������η��ӣ�������109.5�㣬�����������ַ��ӵļ���Cse2>CCl4>H2Se��
��3��H2SeO3�����������ǻ�������ԭ�Ӽ۲���Ӷ�Ϊ4���ӻ�������sp3��H2SeO3��H2SeO4��H2SO4������ķ��ǻ���ԭ�����ֱ���1��2��2���ǽ����ԣ�S>Se������������H2SO4>H2SeO4>H2SeO3��
��4����ʯī������̼ԭ��A��B ����������ֱ�Ϊ: A��0��0��0)��B(0��1��1/2)����Cԭ�ӵ��������Ϊ(1/3��2/3��1/2)��
��ʯī������Ԫ��ƽ������2��̼ԭ�ӣ������Ϊ![]() a2pm2���������Ϊd��
a2pm2���������Ϊd��![]() a2pm3����ʯī���ܶ�Ϊ
a2pm3����ʯī���ܶ�Ϊ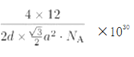 g/cm3(д������ʽ����)��
g/cm3(д������ʽ����)��
��ƽ��ÿ4����Ԫ������1��Li+��ÿ����Ԫ��ƽ������2��̼ԭ�ӣ�����W�Ļ�ѧʽΪC8Li����֮����ڵĻ�ѧ���н���ԭ����ǽ���ԭ��֮���γɵ����Ӽ��ͷǽ���ԭ��֮��Ĺ��ۼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. ���ǻ�����ȩ�ķе�ȶ��ǻ�����ȩ�ĸ�
B. ��̬̼ԭ�ӵ����������Ų�ͼ:![]()
C. ԭ�Ӻ���۵����Ų�ʽ�ֱ�Ϊ3s1��3s23p5����Ԫ�أ������γ�AB2�ͻ�����
D. ԭ�Ӻ�������Ų�ʽΪ1s2��ԭ����ԭ�Ӻ�������Ų�ʽΪ1s22s2��ԭ�ӻ�ѧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦN2O4��g��2NO2��g����H=+57kJmol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯��������ͼ��ʾ������˵����ȷ����
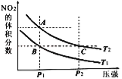
A. A��C����ķ�Ӧ���ʣ�A��C
B. A��C�����������ɫ��A�Cdz
C. A��B���������ƽ����Է���������A��B
D. B��C���㻯ѧƽ�ⳣ����B��C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶���(T2> Tl)����3�������Ϊ2.0 L�ĺ����ܱ������з�Ӧ 2NO(g)+ Cl2(g) = 2ClNO(g)������Ӧ���ȣ��ﵽƽ�⣬����˵����ȷ����

A. �ﵽƽ��ʱ������I������II�е���ѹǿ֮��Ϊ1��2
B. �ﵽƽ��ʱ������III��ClNO��ת����С��80%
C. �ﵽƽ��ʱ������II��c(ClNO(/ c(NO)������I�еĴ�
D. ���¶�ΪTl����ʼʱ��ͬ��������ܱ������г���0.20 mol NO(g)��0.2 mol Cl2(g)��0.20 mol ClNO(g)����÷�Ӧ������Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǹ�ˮ���� {[(CH3COO)2Cr]2��2H2O����Է�������Ϊ376}��һ�����ɫ���壬��������ˮ���dz��õ��������ռ���ʵ��������п�������Ȼ�����Һ����������Һ������Ϊ��Ҫԭ���Ʊ������Ǹ�ˮ�����װ����ͼ��ʾ��������2��Ԥ�ȼ���п������֪���۸����ȶ������ױ���������������п��Ӧ���Ʊ������з�������ط�Ӧ����:
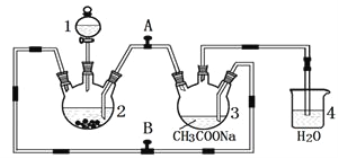
Zn��s��+ 2HCl��aq��=ZnCl2��aq��+ H2��g����
2CrCl3��aq��+Zn��s��= 2CrCl2��aq��+ ZnCl2��aq��
2Cr2+��aq��+ 4CH3COO����aq��+ 2H2O��l��=[(CH3COO)2Cr]2��2H2O��s��
��ش���������:
��1������1��������______________________________________��
��2��������2�м���������Ȼ�����Һ��˳�������____________(�����)��Ŀ����_________________________��
A.��������Ȼ�����Һͬʱ����
B.�ȼ����Ȼ�����Һ��һ��ʱ����ټ�����
C.�ȼ����ᣬһ��ʱ����ټ����Ȼ�����Һ
��3��Ϊʹ���ɵ�CrCl2��Һ���������Һ˳����ϣ�Ӧ�رշ���_____(����A������B"����ͬ)������____��
��4����ʵ����п��Ҫ��������ԭ������ò�����H2��CrCl2��Һѹ��װ��3���������Һ��Ӧ�⣬��һ��������_____________________________________________��
��5����֪������Ӧ��������ʵ��ʱȡ�õ�CrCl3��Һ�к�����9.51g��ȡ�õĴ�������ҺΪ1.5L0.1mol/L��ʵ���ø��﴿����[(CH3COO)2Cr]2��2H2O 9.4g�����ʵ�����ò�Ʒ�IJ���Ϊ____________(�������ܽ�Ĵ����Ǹ�ˮ����)��
��6���������ӻ���Ⱦˮ��������Ҫ��ȥ����ʵ���ж����Cr2+���������Һ��ͨ��������_______���ټ����Һ������pH����Ϊ_______�����Ǹ������ӳ�����ȫ(��������Ũ��ӦС��10-5mol/L)������֪Cr(OH)3���ܶȻ�Ϊ6.3��10-31��![]() ��4��lg2��0.3��
��4��lg2��0.3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС���ͬѧ����ͼ��ʾװ���о��йص绯ѧ������(�ס��ҡ��������е���������)�����պϸ�װ�õĵ��Kʱ���۲쵽��������ָ�뷢����ƫת��

��ش���������:
(1)�׳�Ϊ_________(�ԭ��ء��������ء���Ƴء�)��A�缫�ĵ缫��ӦʽΪ______��
(2)������F�缫Ϊ____(�����������������������������������)���ó��ܷ�Ӧ�ķ���ʽΪ_____��
(3)���ҳ���C����������4.32gʱ���׳���B�缫����������O2�����Ϊ_____mL(��״��)��
(4)һ��ʱ��Ͽ����K������������ʹ�ҳػָ�����ӦǰŨ�ȵ���______(����ĸ)��
A.Cu B.CuO C.Cu(OH)2 D.Cu(OH)2CO3
(5)�״����Ҵ���������ȼ�ϡ���֪�Ҵ�Һ����ȫȼ������CO2�����1molҺ̬ˮʱ�ų�����453.3kJ����д���Ҵ�ȼ�յ��Ȼ�ѧ����ʽ:____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��������仯��˵����ȷ����
A. ������ˮΪ֮��������ˮ��˵����ͬ������ˮ�ͱ���Ƚϣ�����������
B. ��ѧ��Ӧ�����ʱ仯��ͬʱ�������������仯���������ʽֻ�����Ⱥͷ�������
C. ��֪C��ʯī��s��=C�����ʯ��s����H��0������ʯ��ʯī�ȶ�
D. ��ѧ��Ӧ��ѭ�����غ��ͬʱ��Ҳ��ѭ�����غ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵʱ���ɹ۲쵽�����ЧӦ���ǣ� ��
A.�Ҵ���Һ
B.�Ȼ�����Һ
C.����ͭ��Һ
D.������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ʵ�����Ƶõ���ϩ��C2H5OH![]() CH2=CH2��+H2O������ˮ������ȡ1��2����������IJ���װ��ͼ������ͼʾ�ж�����˵����ȷ����
CH2=CH2��+H2O������ˮ������ȡ1��2����������IJ���װ��ͼ������ͼʾ�ж�����˵����ȷ����

A. װ������װ�����ж�ʢ��ˮ����������ͬ
B. װ������װ�����ж�ʢ��NaOH��Һ�������յ�������ͬ
C. ������÷�Һ�ķ������з��룬1��2����������Ӧ�ӷ�Һ©�����Ͽڵ���
D. �Ʊ���ϩ������1��2����������ķ�Ӧ���ͷֱ�����ȥ��Ӧ�ͼӳɷ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com