
【题目】一定温度下(T2> Tl),在3个体积均为2.0 L的恒容密闭容器中反应 2NO(g)+ Cl2(g) = 2ClNO(g)(正反应放热)达到平衡,下列说法正确的是

A. 达到平衡时,容器I与容器II中的总压强之比为1:2
B. 达到平衡时,容器III中ClNO的转化率小于80%
C. 达到平衡时,容器II中c(ClNO(/ c(NO)比容器I中的大
D. 若温度为Tl,起始时向同体积恒容密闭容器中充入0.20 mol NO(g)、0.2 mol Cl2(g)和0.20 mol ClNO(g),则该反应向正反应方向进行
【答案】C
【解析】A. 容器II相当于是0.4mol/LNO与0.2mol/L氯气开始建立平衡,正反应体积减小,相当于容器I增大了压强,平衡正向移动,因此达到平衡时,容器I与容器II中的总压强之比为大于1:2,A错误;B. 容器III相当于是0.2mol/LNO与0.1mol/L氯气开始建立平衡,正反应放热,升高温度平衡逆向移动,因此达到平衡时,容器III中NO的转化率小于容器I中NO的转化率(20%),所以达到平衡时,容器III中ClNO的转化率大于80%,B错误;C. 容器II相当于是0.4mol/LNO与0.2mol/L氯气开始建立平衡,正反应体积减小,相当于容器I增大了压强,平衡正向移动,因此达到平衡时,容器II中c(ClNO(/c(NO)比容器I中的大,C正确;D. 根据容器I中数据可知该温度下平衡常数为![]() ,若温度为Tl,起始时向同体积恒容密闭容器中充入0.20 mol NO(g)、0.2 mol Cl2(g)和0.20 mol ClNO(g),则浓度熵为
,若温度为Tl,起始时向同体积恒容密闭容器中充入0.20 mol NO(g)、0.2 mol Cl2(g)和0.20 mol ClNO(g),则浓度熵为![]() >K,所以该反应向逆反应方向进行,D错误,答案选C。
>K,所以该反应向逆反应方向进行,D错误,答案选C。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】元素①~⑤在元素周期表中的位置如下:
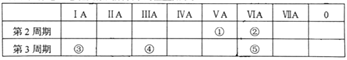
回答下列问题:
(1)元素③~⑤中,原子半径最大的是______________(填元素符号)。
(2)元素②和⑤分别形成的简单氢化物中,热稳定性较强的是______(填化学式)。
(3)元素②与③形成的化合物(原子个数比为1:2)中含有的化学键类型为________。
(4)常温下,少量元素④的单质可溶于______________(填序号)。
a、元素①的最高价氧化物对应的水化物浓溶液中
b、元素③的最高价氧化物对应的水化物浓溶液中
c、元素⑤的最高价氧化物对应的水化物浓溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是由H、O、Na三种元素中的两种或三种组成的化合物。甲、乙、丙是三种单质,分别由上述元素组成。上述单质和化合物之间存在如下反应关系:
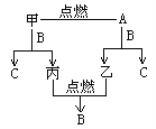
完成下列空白:
(1)B的分子式____________。
(2)写出甲+B→C+丙的化学方程式_______________________________。
(3)用脱脂棉花包住约0.2g A的粉末,置于石棉网上,往脱脂棉花上滴水,可观察到脱脂棉花剧烈燃烧起来。
①由实验现象所得出的有关A和H2O反应的结论是___________(填代号)。
a.反应放热 b.棉花在空气中可以自燃
c.有O2生成 d.A在空气中可以自燃
②写出A和H2O反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A有如图所示的转化关系(部分产物已略去),已知H能使溴的CCl4溶液褪色。
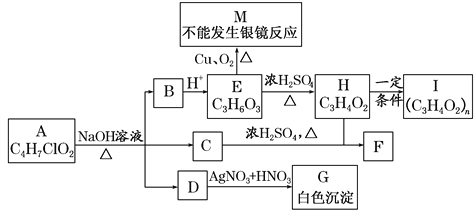
回答下列问题:
(1)A的结构简式为________。
(2)1 mol E与足量NaOH溶液反应时,消耗NaOH的物质的量为________mol。
(3)M的某些同分异构体能发生银镜反应,写出其中任意一种结构简式:________________。
(4)写出化学方程式H―→I:__________________________________。
(5)E通常可由丙烯、NaOH溶液、H2、O2、Br2等为原料合成,请按“A―→B―→C―→…”的形式写出反应流程,并在“―→”上注明反应类型但不需要注明试剂及反应条件________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃与氢气发生反应后能生成(CH3)2CHCH2CH3,则该烃不可能是
A. 2-甲基-2-丁烯 B. 3-甲基-1-丁烯
C. 2.3-二甲基-1-丁烯 D. 3-甲基-1-丁炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化苄(C6H5CH2Cl)是一种重要的有机化工原料。工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄。
(1)写出甲苯与干燥氯气在光照条件下反应合成氯化苄的化学方程式________________。
(2)用下列方法分析氯化苄粗产品的纯度:
步骤I:称取2.555 g样品于烧瓶中,加入100.00 mL 4mol/L氢氧化钠溶液共热,冷却至室温。加入100.00 mL4mol/L硝酸,一段时间后,将烧瓶中的溶液全部转移至250.00 mL的容量瓶中,加水定容。
步骤II:从容量瓶中各取50.00 mL溶液于三只锥形瓶中,各加入25.00 mL0.2000mol/L硝酸银溶液。
步骤m:用硫酸铁铵作指示剂,用0.2000 mol/LNH4SCN溶液分别滴定剩余的硝酸银,所得滴定数据如下表。
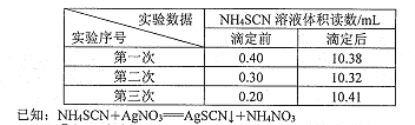
①加入硝酸的目的是____________。
②在步骤III操作中,判断达到滴定终点的现象是____。
③该样品中氯化苄的质量分数(写出计算过程)____。
④上述测定结果通常高于氯化苄中氯元素的理论含量,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图所示实验装置,回答下列问题。
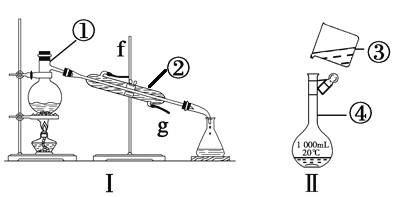
(1)写出下列仪器的名称:①________,②________,④________。
(2)仪器①~④中,使用时必须检查是否漏水的是________(填序号)。
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器________,将仪器补充完整后进行的实验操作的名称为________;②的进水口是________(填“f”或“g”)。
(4)现需配制250 mL、0.2 mol·L-1NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,指出图中的错误操作:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.NaHCO3、CH4均含有离子键和共价键
B.晶体氦He中既无化学键又无分子间作用力
C.只含有共价键的物质是共价化合物
D.原子最外层电子数为5的元素一定是ⅤA族的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】273K、101kPa下,2.8g N2、1.6g O2和2g Ar混合气体的密度是
A. 1.43 g/L B. 1.83 g/L
C. 1.83 mg/L D. 1.43 mg/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com