
【题目】通常工业上监测SO2含量是否达到排放标准的化学反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl,用NA表示阿伏伽德罗常数的值,下列说法不正确的是
A. 0.1 mol BaCl2中所含离子总数为0.3 NA
B. 25℃时,0.1mol/L的HCl溶液中含有H+的数目为0.1 NA
C. 标准状况下,17 g H2O2中所含分子总数为0.5 NA
D. 生成2.33 g BaSO4沉淀时,吸收SO2的体积在标准状况下约为0.224 L
【答案】B
【解析】A.BaCl2为强电解质,1 mol BaCl2溶液中含有离子总数为3NA;B.溶液的体积未知,无法求出H+的数目;C.根据n=m/M进行计算;D.根据V=m×Vm/M进行计算。
0.1 molBaCl2中含有0.1mol Ba2+和0.2molCl-,所含离子总数约为0.3NA,A正确;没有给定溶液的体积,无法求出0.1mol/L的HCl溶液中含有H+的数目,B错误;17gH2O2的物质的量为![]() =0.5mol,所含分子的物质的量为0.5NA,C正确;2.33gBaSO4的物质的量为
=0.5mol,所含分子的物质的量为0.5NA,C正确;2.33gBaSO4的物质的量为![]() =0.01mol,根据方程式可知,吸收SO20.01mol,在标准状况下的体积为0.01mol×22.4L/mol =0.224L,D正确;答案选B。
=0.01mol,根据方程式可知,吸收SO20.01mol,在标准状况下的体积为0.01mol×22.4L/mol =0.224L,D正确;答案选B。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)═B(g)+C(g);△H=﹣48.25kJmol﹣1反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=1.6molL﹣1 , 下列结论正确的是( )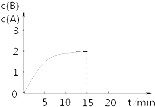
A.该温度下此反应的平衡常数为3.2
B.A的初始物质的量为4 mol
C.反应到达平衡时,放出的热量是193kJ
D.反应达平衡时,A的转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于自然界中氮循环(如图)的说法正确的是
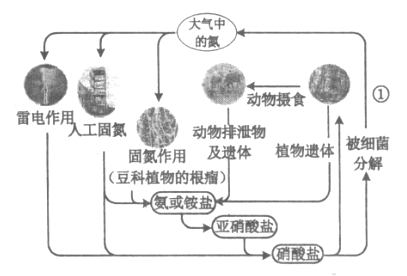
A. “雷电作用”中发生的反应是:![]()
B. 工业合成氨属于人工固氮
C. 氮元素均被还原
D. 过程①必须有O2参与
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温时,一固定容积的容器内发生如下反应:2NO2(g)N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数( )
A.不变
B.增大
C.减小
D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物分离提纯方法正确的是
A.除去乙醇中的水:加入少量金属钠B.除去苯中的溴苯:采用分液法
C.除去乙烯中的甲烷:通入氢氧化钠溶液D.提纯苯甲酸:利用重结晶法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列各项对示意图的解释与图象相符的是( )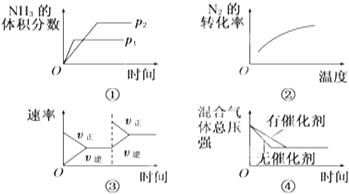
A.①压强对反应的影响(p2>p1)
B.②温度对反应的影响
C.③平衡体系增加N2对反应的影响
D.④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对下面10种元素,完成以下各小题.
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)地壳中含量最多的元素是(填名称).
(2)最高价氧化物对应的水化物碱性最强的是(填化学式).
(3)Al的原子结构示意图为 .
(4)S和Cl相比,元素非金属性较强的是 .
(5)可用来制造光导纤维的物质是 , 晶体硅的主要用途是(写出一种).
(6)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3 , 请写出反应的化学方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com