
【题目】下列分子中所有原子都满足最外层8电子稳定结构的是( )
A.PCl5B.CH4C.BF3D.CS2
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
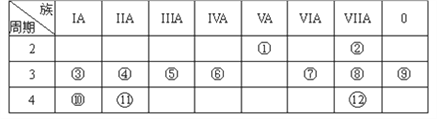
(1)写出元素符号:⑨________(填化学式,下同)
(2)在这些元素中,最活泼的金属元素是________,最活泼的非金属元素是________。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,呈两性的氢氧化物是________。
(4)写出③和⑧形成的化合物的电子式__________________。
(5)写出④和⑧所构成的化合物的化学键类型__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一带一路”为中国化工企业开辟了新的国际市场,而能源、资源整合及环境治理是保驾护航的基础。
Ⅰ.在能源领域,科学家提出“绿色自由“”构想: 把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:
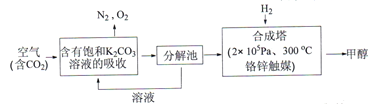
(1)在合成塔中,若有4400gCO2与足量H2完企反应,生成气态的H2O和气态甲醇,可放出5370kJ的热量,写出该反应的热化学方程式__________。
(2)一定条件下,向2L恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内CO2的转化率随温度变化如下图所示:
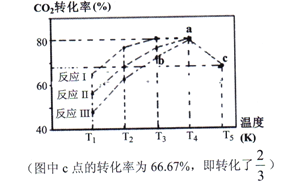
①催化剂效果最佳的反应是__________(填“反应I”,“反应II”,“反应III”)。
②b点v (正)______ v (逆)(填 “>”, “<”, “=”)。
③c点时该反应的平衡常数K =_________。(写单位)
Ⅱ.环境治理中,安装汽车尾气催化转化器的反应是:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)ΔH<0
2CO2(g)+N2(g)ΔH<0
(3)温度升高K值_______(填“增大”或“减小”)
(4)若反应在恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是____________。

(5)下列所示装置可以在吸收SO2的同时,用阴极排出的溶液吸收NO2,(电极均为惰性电极)

a极为______极(填“阴”、“阳”),b极的电极反应式为_________,结合电极反应式简述该装置能吸收SO2的原理:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,正确的是
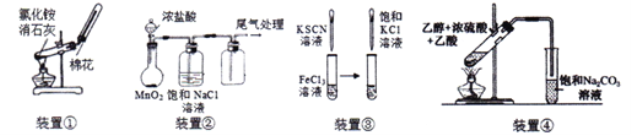
A. 用图①装置制取并收集氨气
B. 用图②装置制取和收集纯净的Cl2
C. 用图③装置可以看到试管内液体变为红色,滴加KCl溶液后颜色加深
D. 用图④装置制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,A、B、C三种气体物质的浓度随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为________________;
(2)从开始至2min,B的平均反应速率为_______________;平衡时,C的浓度为_____________ ,A的转化率为________________;
(3)反应达平衡时体系的压强是开始时的________________倍;
(4)下列叙述能说明该反应已达到化学平衡状态的是(填标号)________________;
A.A、B、C的物质的量之比为3:1:3
B.相同时间内消耗3molA,同时生成3molC
C.相同时间内消耗3n molA,同时消耗n mol的B
D.混合气体的总质量不随时间的变化而变化
E.B的体积分数不再发生变化
(5)在某一时刻采取下列措施能使该反应速率减小的是______________。
A.加催化剂 B.降低温度
C.体积不变,充入A D.体积不变,从容器中分离出A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空
(1)写出CH3CH=CH2的键线式
(2)乙炔的空间构型是
(3)主链有4个碳原子且分子式为C4H10的物质的结构简式是
(4)用系统命名法命名下列有机物: ①CH3CH(CH3)CH(CH3)CH2CH3
②CH3CH(CH3)CH2OH
(5)高聚物 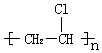 的单体是 .
的单体是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常工业上监测SO2含量是否达到排放标准的化学反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl,用NA表示阿伏伽德罗常数的值,下列说法不正确的是
A. 0.1 mol BaCl2中所含离子总数为0.3 NA
B. 25℃时,0.1mol/L的HCl溶液中含有H+的数目为0.1 NA
C. 标准状况下,17 g H2O2中所含分子总数为0.5 NA
D. 生成2.33 g BaSO4沉淀时,吸收SO2的体积在标准状况下约为0.224 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)广泛用于彩色玻璃和陶瓷。工业上用精炼铜的阳极泥(含有质量分数为8%的TeO2、少量Ag、Au)为原料制备单质碲的一种工艺流程如下:(已知TeO2微溶于水,易溶于强酸和强碱)
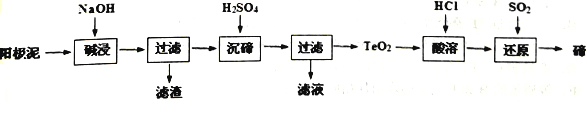
下列有关说法不正确的是
A. 将阳极泥研磨、反应适当加热都有利于提高“碱浸”的速率和效率
B. “沉碲”时为使碲元素沉淀充分,应加入过量的硫酸
C. “碱浸”时发生主要反应的离子方程式为TeO2+2OH-=TeO32-+H2O
D. 若提取过程碲元素的回收率为90%,则处理IKg这种阳极泥最少需通入标准状况下SO220.16L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com