
【题目】将浓度为0.1molL﹣1HF溶液加水不断稀释,下列各量始终保持增大的是( )
A.c(H+)
B.Ka(HF)
C.![]()
D.![]()
【答案】D
【解析】A、因HF为弱酸,则浓度为0.1molL﹣1HF溶液加水不断稀释,促进电离,平衡正向移动,电离程度增大,n(H+)增大,但c(H+)不断减小,故A不符合题意;
B、因电离平衡常数只与温度有关,则Ka(HF)在稀释过程中不变,故B不符合题意;
C、因稀释时一段时间电离产生等量的H+和F﹣,溶液的体积相同,则两种离子的浓度的比值不变,但随着稀释的不断进行,c(H+)不会超过10﹣7molL﹣1,c(F﹣)不断减小,则比值变小,故C不符合题意;
D、因Ka(HF)= ![]() ,当HF溶液加水不断稀释,促进电离,c(F﹣)不断减小,Ka(HF)不变,则
,当HF溶液加水不断稀释,促进电离,c(F﹣)不断减小,Ka(HF)不变,则 ![]() 增大,故D符合题意;
增大,故D符合题意;
故答案为:D.
氢氟酸属于弱电解质,存在电离平衡,加水稀释过程中,随浓度的减小,电离度增大,根据进行分析即可.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硅及其化合物在材料领域中应用广泛。下列叙述正确的是( )
A.晶体硅可做光导纤维
B.SiO2 可与水反应制备硅胶
C.玻璃、水泥、陶瓷都是硅酸盐产品
D.SiO2 与 NaOH 和 HF 均可反应,属于两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温时,一固定容积的容器内发生如下反应:2NO2(g)N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数( )
A.不变
B.增大
C.减小
D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物分离提纯方法正确的是
A.除去乙醇中的水:加入少量金属钠B.除去苯中的溴苯:采用分液法
C.除去乙烯中的甲烷:通入氢氧化钠溶液D.提纯苯甲酸:利用重结晶法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列各项对示意图的解释与图象相符的是( )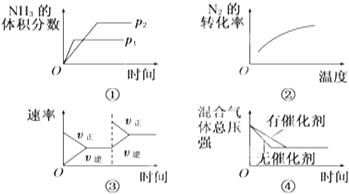
A.①压强对反应的影响(p2>p1)
B.②温度对反应的影响
C.③平衡体系增加N2对反应的影响
D.④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4,硼为+3价)为白色粉末,在干燥空气中稳定,在潮湿空气中分解,是常用的还原剂。偏硼酸钠(NaBO2)易溶于水,不溶于乙醇,易水解。目前有多种工艺可制备NaBH4。
(1)用硼精矿(含有一定量B2O3,及Al2O3、SiO2、Fe2O3等杂质)制取NaBH4的流程如下:

① “溶解”时,B2O3与NaOH反应生成了NaBO2,反应离子方程式为________。
② “除硅铝”步骤加入CaO,而不加入CaCl2的原因有:能将硅、铝以沉淀除去;尽量不带入杂质离子;________。
③ “操作2”是将滤液蒸发、结晶、洗涤,其中洗涤选用的试剂最好是________。
④ “反应1”是MgH2与NaBO2混合得到NaBH4和MgO,其化学方程式为________。
(2)我国孙彦平采用耐腐蚀电极材料,以阳离子交换膜为隔离膜,电解偏硼酸钠的碱溶液,也可以高效制备NaBH4。该工艺阳极产物为________,阴极电极方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com