
【题目】硅及其化合物在材料领域中应用广泛。下列叙述正确的是( )
A.晶体硅可做光导纤维
B.SiO2 可与水反应制备硅胶
C.玻璃、水泥、陶瓷都是硅酸盐产品
D.SiO2 与 NaOH 和 HF 均可反应,属于两性氧化物
科目:高中化学 来源: 题型:
【题目】乙二醇(沸点:197.3℃)是一种重要的基础化工原料。由煤基合成气(主要成分CO、H2)与氧气先制备得到草酸二甲酯(沸点:164.5℃),再加氢间接合成乙二醇,具有反应条件温和、环境污染小等优点。反应过程如下:
反应I:4NO(g)+4CH3OH(g)+O2(g)![]() 4CH3ONO(g)+2H2O(g) △H1 =a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 =a kJ·mol-1
反应II:2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
反应III:CH3OOCCOOCH3(1)+4H2(g)![]() HOCH2CH2OH(1)+2CH3OH(g)△H3 =c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g)△H3 =c kJ·mol-1
请回答下列问题:
(1)煤基合成气间接合成乙二醇的总热化学方程式是_____________________________,已知该反应在较低温条件下能自发进行。说明该反应的△H ______0(填“>”“<”或“=”)。
(2)CO、CH3ONO各0.4mol在恒温、容积恒定为2L的密闭容器中发生反应II,达到平衡时CO的体积分数与NO的体积分数相等,计算该反应的化学平衡常数K=_____________。若此时向容器中再通入0.4molNO,一段时间后,达到新平衡时NO的体积分数与原平衡时相比______(填“增大”“相等”“减小”或“不能确定”)。
(3)温度改变对反应II的催化剂活性有影响,评价催化剂的活性参数——空时收率和CO的选择性可表示如下:
空时收率=CH3OOCCOOCH3质量/反应时间×催化剂的体积
CO的选择性=合成[CH3OOCCOOCH3所消耗的CO的物质的量/反应掉的CO的物质的量]×100%
在不同温度下,某学习小组对四组其他条件都相同的反应物进行研究,经过相同时间th,测得空时收率、CO的选择性数据如下表所示。
反应温度(℃) | 空时收率(g·mL-1·h-1) | CO的选择性(%) |
130 | 0.70 | ①72.5 |
140 | 0.75 | ②71.0 |
150 | 0.71 | ③55.6 |
160 | 0.66 | ④63.3 |
下列说法正确的是________(填字母代号)。
A.温度升高,空时收率先增大后减小,说明△H2>0
B.温度升高,催化剂活性逐渐减弱,对CO的选择性逐渐降低
C.综合考虑空时收率和CO的选择性,工业生成CH3OOCCOOCH3时,选择140℃效果最好
D.130℃时,CO的选择性最高,说明CO生成CH3OOCCOOCH3的转化率最高
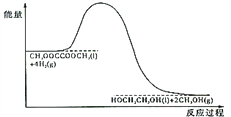
(4)120℃、常压时,CH3OOCCOOCH3+4H2![]() HOCH2CH2OH+2CH3OH反应过程中的能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中的能量变化图。________
HOCH2CH2OH+2CH3OH反应过程中的能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中的能量变化图。________
(5)研究证实,乙二醇、氧气可以在碱性溶液中形成燃料电池,负极的电极反应式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
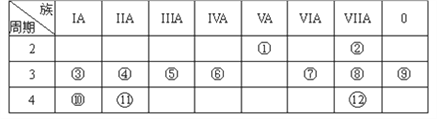
(1)写出元素符号:⑨________(填化学式,下同)
(2)在这些元素中,最活泼的金属元素是________,最活泼的非金属元素是________。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,呈两性的氢氧化物是________。
(4)写出③和⑧形成的化合物的电子式__________________。
(5)写出④和⑧所构成的化合物的化学键类型__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类及胶体性质描述正确的是 ( )
A.熟石灰、烧碱、纯碱都是碱
B.明矾、漂白粉、硫酸铜均为纯净物
C.“血液透析”和“静电除尘”分别利用了胶体的不同性质
D.纳米材料粒子直径一般从几纳米到几十纳米,因此纳米材料属于胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸埃克替尼片又名凯美纳是我国自主研发的治疗肺癌良药,以下是制备盐酸埃克替尼的其中一条合成路线:
(已知: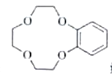 结构片段可以简写为
结构片段可以简写为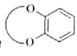 )
)
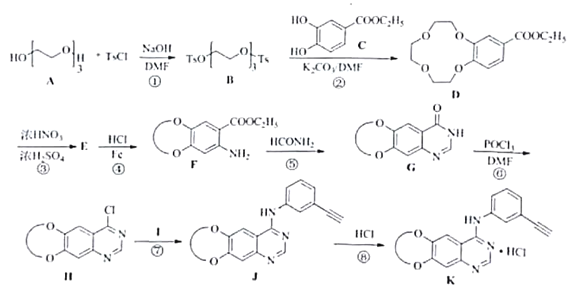
(1)化众物F中含氧官能团名称是_______,________。
(2)反应①⑦的反应类型分别是_________,_________。
(3)化合物Ⅰ的结构简式为_________。
(4)反应③的化学方程式为_________
(5)化介物M是化合物C的同系物,分子式为C8H5O4,其同分异构体有多种,其中同时满足下列三个条件的同分异构体有____种。
①能发生银镜反应
②不含醇羟基
③含有的官能团数目、种类及苯环上取代基数目与化合物C都完全相同。
其中核磁共振氢谱上显示苯环上只有2组峰,峰面积比例为1:2的同分异构体的结构简式为__________。
(6)三缩乙二醇(A)可以由三分子乙二醇在浓硫酸加热条件下缩合得到。请从最简单的烯烃出发,经三步合成三缩乙二醇,请完成合成路线。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
Ⅰ.配制100mL 0.10mol/L NaOH标准溶液.
Ⅱ.取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如表.
实验编号 | NaOH溶液的浓度(mol/L) | NaOH溶液的体积 | 待测盐酸溶液的体积(mL) |
① | 0.10 | 20.00 | |
② | 0.10 | 18.56 | 20.00 |
③ | 0.10 | 18.54 | 20.00 |
(1)第1次实验滴定前液面在0刻度,滴定后如图所示,则第一次实验滴定完用去NaOH溶液的体积记录为mL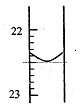
(2)根据上述数据,可计算出该盐酸的浓度为 .
(3)在上述实验中,下列操作会造成测定结果偏高的有
A.滴定终点时俯视读数
B.酸式滴定管使用前,水洗后未用待测稀盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液,定容时仰视
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一带一路”为中国化工企业开辟了新的国际市场,而能源、资源整合及环境治理是保驾护航的基础。
Ⅰ.在能源领域,科学家提出“绿色自由“”构想: 把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:
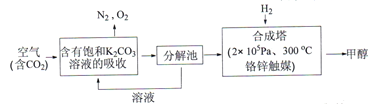
(1)在合成塔中,若有4400gCO2与足量H2完企反应,生成气态的H2O和气态甲醇,可放出5370kJ的热量,写出该反应的热化学方程式__________。
(2)一定条件下,向2L恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内CO2的转化率随温度变化如下图所示:
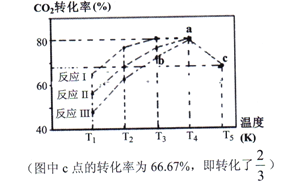
①催化剂效果最佳的反应是__________(填“反应I”,“反应II”,“反应III”)。
②b点v (正)______ v (逆)(填 “>”, “<”, “=”)。
③c点时该反应的平衡常数K =_________。(写单位)
Ⅱ.环境治理中,安装汽车尾气催化转化器的反应是:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)ΔH<0
2CO2(g)+N2(g)ΔH<0
(3)温度升高K值_______(填“增大”或“减小”)
(4)若反应在恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是____________。

(5)下列所示装置可以在吸收SO2的同时,用阴极排出的溶液吸收NO2,(电极均为惰性电极)

a极为______极(填“阴”、“阳”),b极的电极反应式为_________,结合电极反应式简述该装置能吸收SO2的原理:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,正确的是
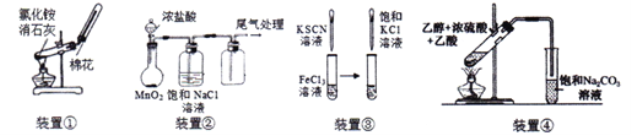
A. 用图①装置制取并收集氨气
B. 用图②装置制取和收集纯净的Cl2
C. 用图③装置可以看到试管内液体变为红色,滴加KCl溶液后颜色加深
D. 用图④装置制取乙酸乙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com