
【题目】下列说法正确的是( )
A.硫酸氢钠溶液中,c(Na+)>c(SO42-)B.醋酸钠溶液中,c(Na+)>c(CH3COO-)
C.碳酸钠溶液中,c(HCO3-)>c(OH--)D.碳酸氢钠溶液中,c(CO32-)>c(H+)
【答案】B
【解析】
A. NaHSO4在水溶液中电离方程式为:NaHSO4=H++Na++SO42-,故硫酸氢钠溶液中,c(Na+)=c(SO42-),故A选项错误。
B. 醋酸钠溶液中,CH3COO-会水解,故c(Na+)>c(CH3COO-),故B选项正确。
C. 碳酸钠溶液中,CO32-+H2O![]() HCO3-+OH-,碳酸氢根跟氢氧根是1:1,但由于存在水的电离,所以氢氧根肯定大于碳酸氢根,故c(OH-)>c(HCO3-),故C选项错误。
HCO3-+OH-,碳酸氢根跟氢氧根是1:1,但由于存在水的电离,所以氢氧根肯定大于碳酸氢根,故c(OH-)>c(HCO3-),故C选项错误。
D. 碳酸氢钠溶液中,HCO3-每电离1mol,便产生等物质的量的CO32-和H+,在这个基础上再考虑水的电离,故有c(H+)>c(CO32-),故D选项错误。
故答案选B。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】(1)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:P-P:198kJ·mol-1,P-O:360 kJ·mol-1,O=O:498kJ·mol-1,则反应P4(白磷)与O2反应生成P4O6的热化学反应方程式为____。

(2)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJ/mol
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJ/mol
写出肼和N2O4反应的热化学方程式_____。
(3)化学反应N2+3H2![]() 2NH3的能量变化如图所示,该反应生成NH3(l)的热化学方程式是_____。
2NH3的能量变化如图所示,该反应生成NH3(l)的热化学方程式是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂,下图是在实验室中制备KMnO4晶体的流程:
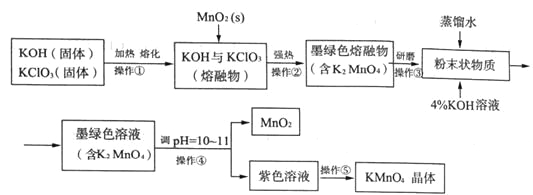
回答下列问题:
(1)操作②目的是获得K2MnO4,同时还产生了KCl和H2O,试写出该步反应的化学方程式: _______________。操作①和②均需在坩埚中进行,根据实验实际应选择_______________(填序号)。
a.瓷坩埚 b.氧化铝坩埚 c.铁坩埚 d.石英坩埚
(2)操作④是使K2MnO4转化为KMnO4和MnO2,该转化过程中发生反应的离子方程式为_______________。若溶液碱性过强,则MnO4-又会转化为MnO42-,该转化过程中发生反应的离子方程式为_______________。因此需要通入某种气体调pH=10-11,在实际操作中一般选择CO2而不是HCl,原因是_______________。
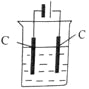
(3)操作⑤过滤时,选择图2所示装置而不用图1所示装置的原因是_______________。

(4)还可采用电解K2MnO4溶液(绿色)的方法制造KMnO4(电解装置如图所示),电解过程中右侧石墨电极的电极反应式为_______________。溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能的原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲烷和CO2的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合CO2重整反应有:
反应(i):2CH4(g)+O2(g)![]() 2CO(g)+4H2(g) △H=-71.4kJmol-1
2CO(g)+4H2(g) △H=-71.4kJmol-1
反应(ii):CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+247.0kJmol-1
2CO(g)+2H2(g) △H=+247.0kJmol-1
(1)写出表示CO燃烧热的热化学方程式:_____。
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ii):CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)(不发生其它反应),CO2的平衡转化率如下表所示:
2CO(g)+2H2(g)(不发生其它反应),CO2的平衡转化率如下表所示:
起始物质的量(n)/mol | CO2的平衡转化率 | ||||
CH4 | CO2 | CO | H2 | ||
Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
Ⅱ | 0.1 | 0.1 | 0.2 | 0.2 | / |
①下列能说明反应达到平衡状态是_____。
A.v正(CH4)=2v逆(CO)
B.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②若容器Ⅰ内反应从开始到平衡所用的时间为tmin,则tmin内该反应的平均反应速率为:v(H2)=____(用含t的表达式表示)。
③达到平衡时,容器Ⅰ、Ⅱ内CO的物质的量的关系满足:2n(CO)Ⅰ___n(CO)Ⅱ(填“>”、“=”或“<”)。
(3)将CH4(g)和O2(g)以物质的量比为4:3充入盛有催化剂的恒容密闭容器内,发生上述反应(i):2CH4(g)+O2(g)![]() 2CO(g)+4H2(g)
2CO(g)+4H2(g)

①T2℃时,CO体积分数最大的原因是____。
②若T2℃时,容器内起始压强为P0,平衡时CO的体积分数为20%,则反应的平衡常数KP=___(用平衡分压强代替平衡浓度计算,分压=总压×物质的量分数)。
(4)2016年我国科研人员根据反应Na+CO2→Na2CO3+C(未配平)研制出一种室温“可呼吸”Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。其放电时的工作原理如图所示,已知吸收的全部CO2中,有![]() 转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:___。
转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组在实验室对酸碱中和反应进行探究
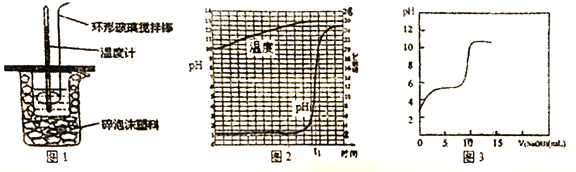
(1)中和热的测定:用50mL 0.5mol/L 的盐酸与50mL 0.55mol/L 的NaOH溶液在如图1所示装置中进行中和热测定,若用等体积等浓度的醋酸代替盐酸,测得中和热数值____。(填“偏大”、“偏小”或“无影响”)
(2)中和滴定:取一定量的稀盐酸,逐滴滴加NaOH溶液,边滴加边振荡。
①指示剂法:用___________(填仪器名称)取一定体积的稀盐酸于锥形瓶中,滴加几滴甲基橙作指示剂,滴定达到终点的现象为__________。
②传感器法:用传感器实时获得溶液的pH、温度曲线如图2所示,当反应达到终点时,溶液的温度为____℃。若用等浓度的醋酸代替稀盐酸,用传感器实时获得溶液的pH如图3所示,图2与图3中溶液起始pH后者较大的原因是__________,图3中反应终点时溶液pH约为8,请用离子方程式表示其原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为两种途径制备硫酸的过程(反应条件略),下列说法不正确的是( )

A. 途径②增大O2浓度可提高SO2转化率
B. 含l mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热
C. 途径②中SO2和SO3均属于酸性氧化物
D. 若△Hl<△H2+△H3,则2H2O2(aq)=2H2O(1) +O2(g)为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)常温下,向100mL0.01molL-1HA的溶液中逐滴加入0.02molL-1MOH溶液,所得溶液的pH随MOH溶液的体积变化如图所示(溶液体积变化忽略不计)。

①常温下,0.01molL-1HA溶液中由水电离出的c(H+)=______molL-1。
②常温下一定浓度的MA稀溶液的pH=a,则a__7(填“>”、“<”或“=”),用离子方程式表示其原因为_______________________________________;
③X点时,溶液中c(H+)、c(M+)、c(A—)由大到小的顺序是___________________;
④K点时,溶液中c(H+)+c(M+)—c(OH—)=____molL-1。
⑵20℃时,在c(H2C2O4)+c(HC2O4—)+c(C2O42—)=0.100molL—1的H2C2O4、NaOH混合溶液中,H2C2O4、HC2O4-、C2O42-的物质的量分数δ随溶液pH变化的关系如图所示。

①Q点:c(H2C2O4)______c(HC2O4—)(填“>”、“<”或“=”)
②该温度下HC2O4-的电离常数K=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,改变反应物中n(SO2),对反应2SO2(g)+O2(g)2SO3(g) ΔH<0的影响如图所示,下列说法正确的是( )
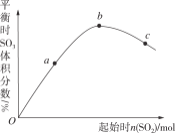
A.反应bc点均为平衡点,a点未达到平衡且向正反应方向进行
B.abc三点的平衡常数Kb>Kc>Ka
C.上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高
D.abc三点中,a点时SO2的转化率最高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com