
下列关于“过氧化氢”的说法正确的是
A.过氧化氢具有杀菌消毒作用,是强酸
B.过氧化氢是离子化合物
C.过氧化氢可以发生分解反应
D.过氧化氢是水的同分异构体
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
已知:X+Y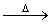 Z+W
Z+W
(1)Y的电子式是_________________________。
(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是_________________________________。
(3)用图示装置制备NO并验证其还原性。有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
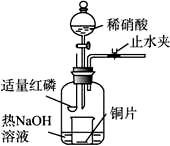
①步骤c后还缺少的一步主要操作是_______________________________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是 ______________________________________。
③步骤c滴入稀硝酸后烧杯中的现象是______________________________________
____________________________________________________________________。
反应的离子方程式是____________________________________________________。
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
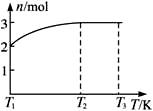
①温度在T1~T2之间,反应的化学方程式是_________________________。
②温度在T2~T3之间,气体的平均相对分子质量是(保留1位小数)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上生产硫酸时,利用催化氧化反应将SO2 转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为: SO2 7% ,O2 11%,N2 82%):
SO2 7% ,O2 11%,N2 82%):
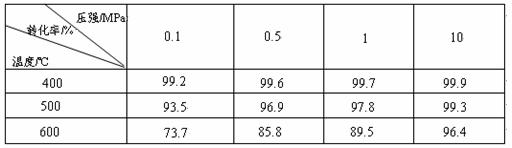
(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?
;
(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
;
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用 吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.6kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z都是短周期的元素,它们的原子序数依次递增。X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层的三倍,Y和Z可以形成两种以上气态化合物,则
(1)X是 ,Y是 ,Z是 。
(2)由Y和Z组成,且Y和Z的质量比为7:20的化合物的化学式(分子式)是 。
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是 和 。
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4:2:3,该盐的化学式(分子式)是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
A、HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3¯)>c(OH¯)
B、HN3与NH3作用生成的叠氮酸铵是共价化合物
C、NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3¯) >c(OH¯)>c(H+)
D、N3¯与CO2含相等电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
碘元素有多种价态,可以形成多种含氧阴离子IxO 。由2个IO
。由2个IO 正八面体共用一个面形成的IxO
正八面体共用一个面形成的IxO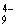 的化学式为
的化学式为
A.I2O B.I2O
B.I2O C.I2O
C.I2O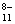 D.I2O
D.I2O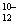
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。
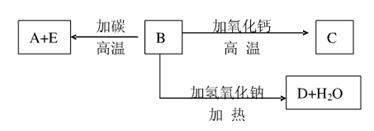
请填空:
形成单质A的原子的结构示意图为_________________,它的最高化合价为______________。
B的化学式(分子式)为_______________,B的晶体类型为___________,B和碳反应生成A和E的化学方程式是_________。
C的化学式(分子式)为___________,D的化学式(分子式)为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高.则下列溶液沸点最高的是( )
A.0.01 mol/L的蔗糖溶液 B.0.01 mol/L的CaCl2溶液
C.0.02 mol/L的NaCl溶液 D.0.02 mol/L的CH3COOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是实验室制取SO2并验证SO2的某些性质的装置图。试回答下列问题。

(1)在⑥中发生的化学反应方程式为_________________________________。
(2)①中的实验现象为石蕊试液________,此实验证明SO2与水反应生成产物呈________性。
(3)②中的品红溶液________,证明SO2有________。
(4)③中的实验现象是___________________________________________,证明SO2有________性。
(5)④中的实验现象是___________________________________________________________,
证明SO2有________性。
(6)⑤的作用是______________________________________________________________,
反应的化学方程式为________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com