


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
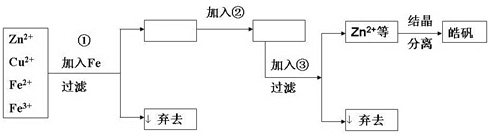
查看答案和解析>>
科目:高中化学 来源: 题型:

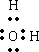
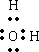
| 加热 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源:2008年普通高等学校招生统一考试理综试题化学部分(四川卷) 题型:实验题
(浙江舟山中学2009届度第一学期高三期中考试,化学,24)某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。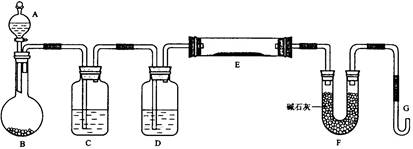
请回答下列问题。
(1)仪器中装入的试剂:B_________ 、C________、D___________;
(2)连接好装置后应首先_________________________;
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是:
____________________。在这两步之间还应进行的操作是_____________________;
(4)反应过程中G管逸出的气体是________________,其处理方法是:
______________________________________________________________________。
(5)从实验中测得了下列数据
①空E管的质量a
②E管和WO3的总质量b
③反应后E管和W粉的总质量c(冷却到室温称量)
④反应前F管及内盛物的总质量d
⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(W)=____________;计算式2:Ar(W)=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com