
【题目】用30g乙酸与46g乙醇反应,如果实际产率是理论产率的67%,则可得到的乙酸乙酯的质量是( )
A.29.5 g
B.44 g
C.74.8 g
D.88 g
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4;M原子最外层电子数与次外层电子数之比为3:4;N﹣、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体.据此回答:
(1)M、N的最高价氧化物的水化物中酸性较强的是(写出化学式) .
(2)Z与M可形成常见固体化合物C,用电子式表示C的形成过程 .
(3)已知通常状况下1 g X2在Y2中完全燃烧放出a kJ的热量,请写出表示X2燃烧热的热化学方程式 .
(4)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式 .
(5)化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1:1:1,A溶液中水的电离程度比在纯水中小.则化合物A中的化学键类型为;若B为常见家用消毒剂的主要成分,则B的化学式是 .
(6)均由X、Y、Z、M四种元素组成的两种盐发生反应的离子方程式是;其中一种是强酸所成的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题;(回答问题时,均需使用元素的真实元素符号,不得使用数字编号)
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | Ⅷ |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)②、⑤、⑥的离子半径由大到小的顺序为
(2)写出由①、②两元称组成,且①的质量分数最高的分子的电子式 ,
写出该化合物跟⑧的单质发生置换反应的化学方程式 .
(3)元素⑥的最高价氧化物可和元素⑤的氢氧化物水溶液发生反应,写出反应的离子方程式
(4)元素③有多种氧化物,其中甲的相对分子质量最小;元素④有多种单质,其中乙的相对分子质量最小.在一定条件下,将2L 甲气体与1.5L 乙气体均匀混合,若该混合气体被足量NaOH 溶液完全吸收(没有气体残留).所生成的含氧酸盐的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲制备FeCl3固体。已知FeCl3固体易吸水潮解。现利用下图装置制取FeCl3固体。
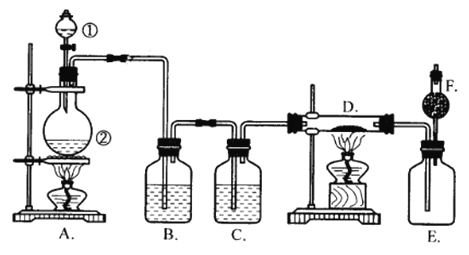
(1)分液漏斗①中放浓硫酸,烧瓶②中放固体氯化钠和二氧化锰,将浓硫酸滴加到烧瓶中共热。分两步写出反应的化学方程式:①_________________,②__________。
(2)为了获得纯净干燥的氯气,应除杂和干燥。在B瓶中的液体应是__________,其作用____________________;在C瓶中的液体应是________,其作用是________________。
(3)D中盛放的固体是铁粉,其中的反应方程式为___________________。在D及E装置中观察到现象是_________________________。
(4)F中装的是碱石灰(主要成分是CaO与NaOH),F的作用是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为( )
A.V(酸)=102V(碱)
B.V(碱)=102V(酸)
C.V(酸)=2V(碱)
D.V(碱)=2V(酸)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(能用键能大小解释的是( )
A.稀有气体一般很难发生化学反应
B.常温常压下,氟气的密度小于氯气
C.相同条件下,NH3在水中的溶解度大于PH3
D.SiC晶体的熔点比晶体硅的高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图海水综合利用的工业流程图,判断下列说法正确的是( ) 
已知:MgCl26H2O受热生成Mg(OH)Cl和HCl气体等.
A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B.在过程③中将MgCl26H2O灼烧即可制得无水MgCl2
C.在过程④、⑥反应中每氧化0.2 mol Br﹣需消耗2.24LCl2
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类的正确组合是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Cu2(OH)2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | NH3 | CaCl2 | MgO | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1.01×105 Pa、298K条件下,2mol H2燃烧生成水蒸气时放出484kJ热量.下列热化学方程式中正确的是( )
A.H2O(g)═H2(g)+ ![]() O2(g)△H=+242 kJ?mol﹣1
O2(g)△H=+242 kJ?mol﹣1
B.2H2(g)+O2(g)=2H2O(l)△H=﹣484 kJ?mol﹣1
C.H2O(g)+ ![]() O2(g)=H2O(g)△H=+242 kJ?mol﹣1
O2(g)=H2O(g)△H=+242 kJ?mol﹣1
D.2H2(g)+O2(g)═2H2O(g)△H=+484 kJ?mol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com