
����Ŀ������Ŀǰ�����������ߵĽ�������ش�
��1�������У������������������˽�������_______�ԡ�
��2����֤����ͭ�Ľ������˳�������Ҫ�õ���һ���Լ���_________��
��3��Сٻͬѧ���ݹ�ҵ������ԭ�����������ͼ��ʾװ�ý���ʵ�顣
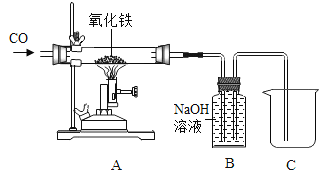
��ʵ�鿪ʼʱ��Ӧ�ȸ����������Ȼ���ͨһ����̼______��
�ڼ���һ��ʱ���Aװ�ò������ڵ�������______����Ӧ�Ļ�ѧ����ʽΪ_____________��
������Ϊ��װ���Ƿ���Ҫ����β������װ�ò�˵������ _______________ ��
���𰸡� ���� CuSO4 ��ͨһ����̼ ����ɫ��ĩ��� 3CO+ Fe2O3 ���� 2Fe + 3CO2 ����Ҫ����Ϊδ��Ӧ��CO����Bװ���У�������ɢ��������
��������(1)�������������������ܽ�ú��ȼ�շų����������ݸ��ˣ����������ĵ����ԣ�(2)Ҫ�Ƚ�����ͭ�Ľ������˳���������ڽ������˳���У�����ǰ��Ľ�����K��Ca��Na���⣩�ܽ����ں���Ľ�����������Һ���û����������ѡ��������ͬʱ������Ҫѡ�������ͭ����Һ��������ͭ��Һ���Ȼ�ͭ��Һ�ȣ�(3)��CO���п�ȼ�ԣ��벣�����еĿ���������Ȼᷢ����ը�����Ӧ��ͨ��CO�ž��������еĿ�����Ȼ���ٵ�ȼ�����������ľƾ��ƣ���ʵ�鿪ʼʱӦ��ͨCO�ټ��ȣ���Aװ����һ����̼��������������ɫ����Ӧ����������ɫ���Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪFe2O3+3CO![]() 2Fe+3CO2����β����װ��A�ų�������̼��װ��B������������Һ�����գ�һ����̼����װ��B���ռ�����Һ���ų����ձ��У�����β�������ٽ��д���.
2Fe+3CO2����β����װ��A�ų�������̼��װ��B������������Һ�����գ�һ����̼����װ��B���ռ�����Һ���ų����ձ��У�����β�������ٽ��д���.


 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�����е�Ƚϴ�����ǣ� ��
A.���飾���飾����
B.�����飾�����飾������
C.�ڶ��ױ����ױ�����
D.�Զ��ױ����ڶ��ױ�������ױ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���ij�ܱ������н������·�Ӧ��mA��g��+nB��g��pC��g��+qD��g����������ѹǿ�������¶ȣ����´ﵽƽ�⣬��Ӧ������ʱ��ı仯������ͼ��ʾ����Ը÷�Ӧ��������ȷ���ǣ� ��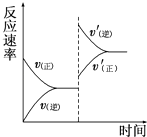
A.����Ӧ�����ȷ�Ӧ
B.�淴Ӧ�Ƿ��ȷ�Ӧ
C.m+n��p+q
D.m+n��p+q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����5.10gþ���Ͻ����120mL4.0molL��1�������У����Ͻ���ȫ�ܽ�õ���ҺX������˵��һ����ȷ���ǣ� ��
A.�Ͻ���ȫ�ܽ�������H2�����ʵ���Ϊ0.24mol
B.�Ͻ��е�þ���������ʵ���֮��С��1
C.������ҺX�м���270mL2.0molL��1NaOH��Һ����ַ�Ӧ�����ó���ΪMg��OH��2
D.������ҺX�м��������İ�ˮ����ַ�Ӧ�����ó����������ˡ�ϴ�Ӻ������գ������������������8.50g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ����Ʒѭ�����õ�ʾ��ͼ������ͼʾ�ش�
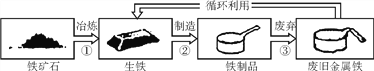
(1)���������������������У�ѡ��һ��������ѧ�仯����____(�����)��
(2)��������������ʢ������ͭ��Һ��ԭ����_____________ (�û�ѧ����ʽ��ʾ)��
(3)�Ͼɽ�����ѭ����������������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �ޡ�˿��ë����֬������Ȼ�л��߷��ӻ�����
B. ������ϩ���Ͽ��������߲�ˮ������ʳ�ȵı���Ĥ
C. ��ά�ء����۶�����(C6H10O5)n��ʾ�����ǻ�Ϊͬ���칹��
D. ���������£�������������������ͭ��Һ��ϼ��ȣ�����ש��ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��С����δ��ɰֽ��ĥ����������ʢ������ϡ������ܱ������У���ѹǿ�������������������ѹǿ������Ӧʱ��ı仯��������ͼ��ʾ��
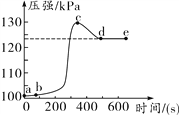
�ش��������⣺
(1)ab�η�����Ӧ�Ļ�ѧ����ʽ��______________��
(2)bc�η�����Ӧ�Ļ�ѧ����ʽ��______________��
(3)cd��ѹǿ�仯����Ҫԭ����__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʳ��������ҩ�����彡������Ҫ�� ������Ӫ�����У����ܶ������ṩ��������������ĸ����
a������ b������ c��������
��ij����Ʒ��װ��ӡ�����������ͼ��ʾ��
�������ڵ�ζ�����������ڷ�ɫ��������
���ڷ��������� ��
�۵�����θ����ڹ���ʱ��ҽ���Ὠ��������³���ҩ���е�������ĸ����
a����˾ƥ�� b����ù��Ƭ c��������������Ƭ d���ϳɿ���ҩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������ά�ء�������ά�ص����ܼ���ʵ���Һϳɼ�����������ķ�Ӧԭ�����й��������£� ![]() +2C2H5OH
+2C2H5OH ![]()
![]() +2H2O
+2H2O
��Է������� | �ܶ�/��gcm��3�� | �е�/�� | ˮ���ܽ��� | |
����������� | 202 | 1.01 | 245 | ������ˮ |
������ | 146 | 1.36 | 231.8 | �� |
�Ҵ� | 46 | 0.79 | 78.4 | ���� |
�ױ� | 92 | 0.87 | 110.6 | ������ˮ |
ʵ�鲽�����£�
����1����50mLԲ����ƿ�м��뼺����1.8g��0.012mol�����Ҵ�4.4mL��0.076mol�����ױ�5mL��Ũ���ᣨ1mL����װ����ͼ��ʾ��С����Ȼ���40min��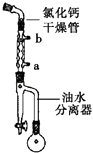
����2����ȴ������װ�ø�Ϊ����װ�ã���ѹ������120�����ҳ������
����3��������2��Һ�嵹�������ƿ�����м�ѹ�������ü����������2.2g��
��1��ͼ������������ȴˮ�����a����b�����ڽ���Ũ�������Ҫ������������ ��
��2������һ��ʱ���ͼ��������������������Ҫ�� ��
��3��ʵ���м���������Ҵ���Ŀ���� ��
��4������2ʵ������ɵı�־�� ��
��5����ʵ��IJ���Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com