
【题目】用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示,则下列说法正确的是( )
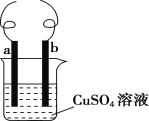
A.构成原电池时b极反应为Cu-2e-=Cu2+
B.构成电解池时a极质量一定减少
C.构成电解池时b极质量可能减少也可能增加
D.构成的原电池或电解池工作后均能产生大量气体
【答案】C
【解析】
A. 构成原电池时,较不活泼的金属铜作正极,正极上溶液中铜离子得电子生成铜单质而析出,电极反应式为Cu2++2e-=Cu,A错误;
B. 构成电解池时,连接电源正极的电极为阳极,阳极上金属电极失电子发生氧化反应,如a连接电源负极,则a电极质量增加,B错误;
C. 构成电解池时,连接电源正极的电极为阳极,阳极上金属电极失电子发生氧化反应,连接电源负极的电极为阴极,阴极上铜离子得电子发生还原反应;如果b为阳极,电解池工作时,铜失电子生成铜离子进入溶液,导致电极质量减少;如果b为阴极,溶液中铜离子得电子生成铜单质而析出附着在b电极上,导致电极质量增加,C正确;
D. 构成原电池时,正极上铜离子得电子而析出;构成电解池时,阴极上溶液中铜离子得电子而析出,所以无论是原电池还是电解池都没有气体生成,D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
A.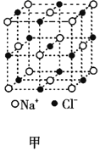 在NaCl晶体(图甲)中,距Na+最近的Cl-围成正八面体
在NaCl晶体(图甲)中,距Na+最近的Cl-围成正八面体
B.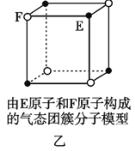 该气态团簇分子(图乙)的分子式为EF或FE
该气态团簇分子(图乙)的分子式为EF或FE
C.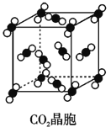 在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻
在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻
D.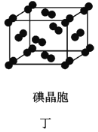 在碘晶体(图丁)中,存在的作用力有非极性键和范德华力
在碘晶体(图丁)中,存在的作用力有非极性键和范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出惰性电极电解AgNO3溶液阳极的电极方程式_______________________。
(2)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
①常温下,某纯碱溶液中滴入酚酞,溶液呈红色,原因是______________________;(用离子方程式表示)
②常温下,在NH4Cl溶液中离子浓度由大到小的顺序为_____________________________;
③某温度时,水的离子积为KW=1×10-13,在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L,则该溶液的pH可能为___________;
④室温下,0.1mol/L的酒石酸(H2C4H4O6)溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6)+2 c(C4H4O62)=__________mol/L。(用计算式表示)
⑤难溶电解质在水溶液中存在溶解平衡。某MgSO4溶液里c(Mg2+)=0.002molL1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于__________;(该温度下Mg(OH)2的Ksp=2×1011)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图A装置常用于实验室制备气体
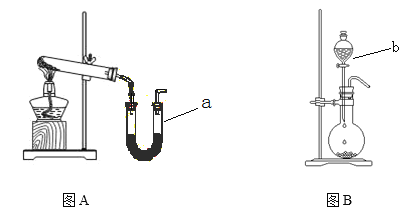
(1)写出实验室用该装置制备O2化学方程式 __________________________________。
(2)若利用该装置制备干燥NH3,试管中放置药品是_______________(填化学式);仪器 a中放置药品名称是________ 。
(3)图B装置实验室可用于制备常见的有机气体是_______。仪器b名称是_________。有学生利用图B装置用浓氨水和生石灰制备NH3,请说明该方法制取NH3的原因 。______________________________________________________________
(4)学生甲按图所示探究氨催化氧化
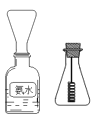
①用一只锥形瓶倒扣在浓氨水试剂瓶口收集氨气 ,然后将红热的螺旋状铜丝插入锥形瓶中;片刻,锥形瓶中气体变为红棕色。下列叙述正确的是_________
A.如图收集氨气是利用氨水的密度较小 B.锥形瓶必须干燥
C.收集氨气时间越长,红棕色现象越明显 D.铜丝能保持红热
②学生乙对学生甲的实验提出了异议,认为实验中产生的红棕色气体可能是空气中的氮气氧化后造成的,你认为学生乙的说法合理吗?请你设计一个简单实验证明学生乙的说法是否正确。_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.用乙醇或CCl4均可提取碘水中的碘单质
B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同
C.PCl3和Na2O2中各原子或离子最外层都满足8电子稳定结构
D.24Mg34S晶体中电子总数与中子总数之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1molA(g)和1molB(g)充入2L密闭容器中发生反应,在t1时达到平衡:A(g)+ B(g)![]() xC(g)+D(s)。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。有关说法正确的是
xC(g)+D(s)。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。有关说法正确的是
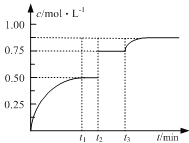
A.反应方程式中x=2
B.t2时刻改变的条件是使用催化剂
C.t3时刻改变的条件是移去少量D
D.t1~t3间该反应的平衡常数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol·L-1) | 10 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
c(CO)/(10-3mol·L-1) | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1) 已知该反应ΔS<0,在上述条件下反应能够自发进行,则反应的ΔH________0(填写“>”“<”或“=”)。
(2)前2 s内的平均反应速率v(N2)=________。
(3)在该温度下,反应的平衡常数表达式K=________。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)青蒿素结构如图,有关叙述正确的是_____(选填序号)。
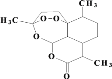
a.化学式为C15H21O5 b.不能与NaOH溶液反应
c.易溶于水 d.含有过氧键,有较强氧化性
由青蒿酸为原料出发,经五步合成可得到青蒿素,其中第2步为还原反应:
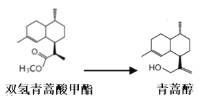
常温下即可反应且略放热,还原剂为LiAlH4。相关物质的性质:
物质 | 性质 |
双氢青蒿酸甲酯(C16H28O2) | 固体,难溶于水,易溶于有机溶剂。 |
青蒿醇(C15H28O) | 固体,难溶于水,易溶于有机溶剂。 |
乙醚 | 无色液体,微溶于水;密度0.71g/cm3;沸点34.6℃。 |
氢化铝锂 | 固体,溶于乙醚。 与水反应:LiAlH4 + 4H2O →Al(OH)3↓+ LiOH +4H2↑ 可将一分子酯还原成二分子醇,自身生成醇铝、醇锂。 (醇铝、醇锂可与盐酸反应,生成铝盐、锂盐和相应的醇)。 |
某学习小组在实验室用双氢青蒿酸甲酯制取青蒿醇。
(2)反应中使用过量的氢化铝锂,理由是_____________________________________________。为使反应在溶液状态下进行,可用乙醚为溶剂,不用水的理由是____________________。
(3)请设计实验室制备装置(画出草图):____________
(4)该反应有机物的转化率约为96%,所得乙醚溶液中含有醇锂、醇铝、双氢青蒿酸甲酯、氢化铝锂。从反应混合物中提取青蒿醇的方法是:
①加_______后分液;
②从乙醚层提取青蒿醇。有多种方法,以下是二种方案:
方案一:蒸发结晶。 方案二:蒸馏析出晶体。
a.这2个方案在析出晶体后都应有残留液,原因是___________________________________。
b.请对这2个方案进行比较_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化镁:①是中强碱;②广泛用作阻燃剂和填充剂.以白云石(化学式:MgCO3CaCO3)为原料制备氢氧化镁的工艺流程如下:
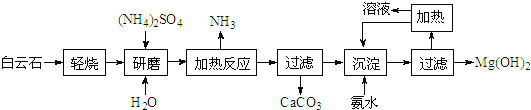
(1)根据流程图,白云石“轻烧”后固体产物的主要成份是MgO和_______(写化学式)。
(2)流程图中“加热反应”有氨气生成的化学方程式为_________________________。
(3)洗涤Mg(OH)2沉淀所用玻璃仪器有:_______、烧杯、玻棒;检验洗净的方法是____________。
(4)传统工艺是将白云石高温分解为氧化镁和氧化钙后提取,而该工艺采用轻烧白云石的方法,其优点是__________________。
(5)25℃时Mg(OH)2饱和溶液的中:c(Mg2+)=2.80×10﹣4mol/L,Mg(O2)22﹣、Mg(OH)42﹣的浓度共为2.35×10﹣4mol/L,则溶液的pH=_______(取整数值);若经过循环利用,每制得5.8t Mg(OH)2时排出200m3的废水,其中Mg2+、Mg(O2)22﹣、Mg(OH)42﹣的浓度共为1.50×10﹣4mol/L,则该工艺的产率为___________(保留4位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com