
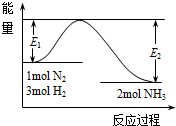
 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.分析 (1)反应热=反应物总键能-生成物总键能,注明物质的聚集状态与反应热书写热化学方程式;焓变和起始和终了状态有关,与变化过程无关,逆反应的活化能为E2,正反应的活化能E1,结合图分析;
(2)可逆反应不能完全反应,0.5molN2和1.5molH2不能全部转化为氨气,该反应的正反应是放热反应;
(3)N2(g)+3H2(g)?2NH3(g)依据三段式结合速率公式进行计算;平衡常数只与温度有关.
解答 解:(1)反应发生:N2(g)+3H2(g)?2NH3(g),则△H=945KJ•mol-1+3×436KJ•mol-1-6×391KJ•mol-1=-93 KJ•mol-1,反应热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-93 KJ•mol-1,逆反应的活化能为E2,正反应的活化能E1,△H=E1-E2,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-93 KJ•mol-1;E1-E2;
(2)当0.5mol N2和1.5mol H2完全反应时,才能放出46.2kJ的热量,但反应为可逆反应,不能完全进行,则密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量小于46.2kJ,
故答案为:<;可逆反应反应物不能完全转化;
(3)将一定量的H2(g)和N2(g)放入2L密闭容器中,在500℃、2×107 Pa下达到平衡,测得N2、H2和NH3的物质的量分别是1mol、2mol、1mol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):1+0.5 2+1.5 0
变化量(mol):0.5 1.5 1
平衡量(mol):1 2 1
起始时N2的物质的量浓度c(N2)=$\frac{1mol}{2L}$=0.5mol/L 用氢气表示该反应的平均速率v(H2)=$\frac{c({H}_{2})}{V}$=$\frac{1.5mol}{\frac{2L}{10min}}$=0.075mol/(L•min),该反应的正反应是放热反应,化学平衡常数增大,平衡正向移动,则降低温度,
故答案为:0.5mol/L;0.075mol/(L•min);降低温度;平衡正向移动.
点评 本题考查了化学反应的能量变化,化学平衡移动影响因素,为高频考点,注意把握图象识别和理解含义,注意三段式在化学平衡计算中应用,注意化学平衡常数只与温度有关,题目难度中等.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 体积不变充入惰性气体,反应速率增大 | |
| B. | 其他条件不变,降低温度,平衡转化率一定变化 | |
| C. | 其他条件不变时,增大压强,平衡左移,平衡常数K减小 | |
| D. | 若增加或减少A物质的量,反应速率一定会发生明显的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
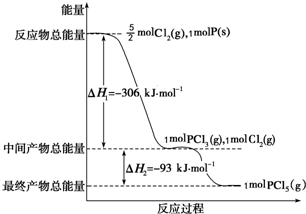 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下在体积为5L的密闭容器中发生可逆反应.
一定温度下在体积为5L的密闭容器中发生可逆反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
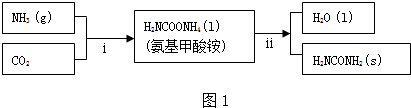

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该试剂的物质的量浓度为9.2 mol•L-1 | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L | |
| C. | 硫酸是强电解质 | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解水生成H2和O2时,化学能主要转化为电能 | |
| B. | 风力发电时,风能主要转化为电能 | |
| C. | 煤燃烧时,热能主要转化为化学能 | |
| D. | 白炽灯工作时,只发生电能转化为光能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com