
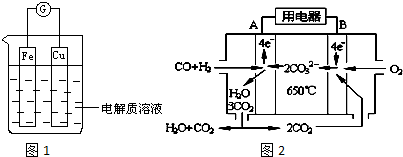
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 |
| B、欲除去Cl2中少量HCl气体,可将此混合气体通过盛饱和食盐水的洗气瓶 |
| C、漂白粉有效成分是CaCl2和Ca(ClO)2,应密闭保存 |
| D、SO2和Cl2都具有漂白作用,所以将两种气体同时作用于潮湿有色物质,可大大增强漂白作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
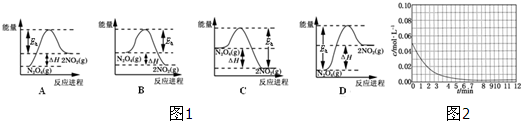
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、棉织品 | B、毛织品 |
| C、腈纶织品 | D、蚕丝织品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加碘食盐能使淀粉溶液变蓝 |
| B、用电石和水反应制乙炔是氧化还原反应 |
| C、1mol乙酸与足量乙醇在浓硫酸催化下加热,可生成1 mol乙酸乙酯 |
| D、利用电石与水反应制取C2H2时,可采用CuSO4溶液除去杂质气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若n为聚合度,则该高分子化合物的相对分子质量为97n |
| B、聚合物的链节为─CHCl─CHCl─CHCl─ |
| C、单体为CH2=CHCl |
| D、聚合物的分子式为 CHCl=CHCln |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该温度高于25℃ |
| B、该温度下加入等体积pH=12的氢氧化钠溶液可使反应后的溶液恰好呈中性 |
| C、水电离出的[H+]=10-10 mol?L-1 |
| D、c(H+)═c(OH-)+c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝跟盐酸反应 |
| B、Ba(OH)2?8H2O和NH4Cl的反应 |
| C、灼热的碳与二氧化碳的反应 |
| D、高温煅烧石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Cl-、NO3- |
| B、K+、CH3COO-、SO42- |
| C、NH4+、HCO3-、K+ |
| D、Na+、NO3-、Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com