
下列实验设计及其对应的离子方程式均正确的是
A.用FeCl3溶液腐蚀铜线路板:Cu + Fe3+=Cu2+ +Fe2+
B.Na与H2O反应制备H2:2Na+2H2O=2Na++2OH-+ H2↑
C.用小苏打治疗胃酸过多:HCO3- + H+=CO2↑+ H2O
D.用食醋除去水瓶中的水垢: CO32- + 2H+=CO2↑+ H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列各分子中,所有原子都满足最外层为8电子结构的是
①H2O 、②BF3 、③CCl4 、④PCl5、⑤XeF4、⑥CO2、⑦BeCl2、⑧Mg3N2、⑨PCl3、⑩CO
A.①③⑥⑧⑨ B.②③⑥⑧⑨
C.③⑥⑧⑨ D.③④⑥⑦⑧⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
将1.92gCu和一定量的浓HNO3 反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
A.1mol B.0.05mol C.1.05mol D.0.11mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中,Cl- 的物质的量浓度与50mL 1mol·L-1 AlCl3溶液中Cl-浓度相等的是
A.150mL 1mol·L-1 NaCl溶液 B.25mL 3mol·L-1 MgCl2溶液
C.150mL 3mol·L-1 KClO3溶液 D.75mL 1mol·L-1 FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
学生利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)

(1)回答下列问题:所用铁粉中若有杂质,欲除去不纯铁粉中混有的铝粉可以选用的试剂为
(填序号)。
A.稀盐酸 B.氢氧化钠溶液 C.浓硫酸 D. FeCl3溶液
此步涉及反应的离子方程式为 。(2)反应发生后装置B中发生反应的化学方程式是 。
D装置的作用: 。(3)该小组学生把B中反应后的产物加入足量的盐酸,过滤,用上述滤液制取FeCl3·6H2O晶体,设计流程如下: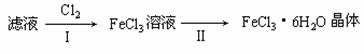
①用离子方程式表示步骤I中通入Cl2的作用 。
②为了检验某未知溶液是否是FeCl2溶液,同学们设计了以下实验方案加以证明。
向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液是FeCl2溶液。你认为此方案是否合理 (填“合理”或“不合理”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如右图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
A.发生氧化反应
B.a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C.放电时,电流从a极经过负载流向b极
D.其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙三种醇与足量金属钠完全反应,在相同条件下产生体积相同的氢气,而消耗这三种醇的物质的量之比为3:6:2,则甲、乙、丙三种醇分子里羟基数之比为( )
A.3:1:2 B.2:3:1 C.2:1:3 D.3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、N、Q为元素周期表前四周期的六种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。请回答下列问题:
⑴X元素在周期表中的位置是 ,属于 区元素,它的外围电子的电子排布图为 。


⑵XZ2分子的立体结构是 ,YZ2分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 。
⑶含有元素N的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其原因是 。
⑷元素M与元素Q形成晶体结构如图所示,设其晶胞边长为a pm,则a位置与b位置之间的距离为_______pm(只要求列算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com