
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
| c(标)×V(标) |
| V(待) |
| c(碱)×V(碱) |
| V(酸) |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |
| 25.35+25.30 |
| 2 |
| c(碱)×V(碱) |
| V(酸) |
| ||
| V |
| ||
| V |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、乙醇分子中甲基的电子式为 |
| B、乙醇结构简式为:C2H6O |
C、乙醇分子中羟基电子式: |
D、乙醇分子的比例模型为: |
查看答案和解析>>
科目:高中化学 来源: 题型:
 立方烷是一种新合成的烃,其分子为正立方体结构,其碳架结构如图所示
立方烷是一种新合成的烃,其分子为正立方体结构,其碳架结构如图所示查看答案和解析>>
科目:高中化学 来源: 题型:
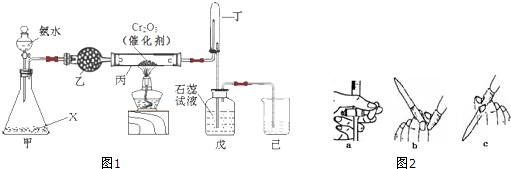
查看答案和解析>>
科目:高中化学 来源: 题型:


| O3 |
| Zn/H2O |
 +R3CHO
+R3CHO查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失 |
| B、锥形瓶用蒸馏水洗净后,未经干燥即进行滴定 |
| C、滴定过程中,锥形瓶中有溶液溅出 |
| D、酸式滴定管未用标准盐酸润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 按要求回答下列问题:
按要求回答下列问题:+ 4 |
| c(CH3COO-) |
| c(CH3COOH)?c(OH-) |
| c(CH3COO-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2个 | B、3个 | C、4个 | D、5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com