
常温下,有①氨水、②NH4Cl溶液、③Na2CO3溶液、④NaHCO3溶液各25mL,物质的
量浓度均为0.1mol·L−1,下列说法正确的是
A.四种溶液的pH的大小顺序:①>④>③>②
B.将溶液①、②等体积混合所得碱性溶液中:c(NH4+)<c(NH3·H2O)
C.向溶液①、②中分别滴加25mL 0.1mol·L−1盐酸后,溶液中c(NH4+):①<②
D.将溶液③、④等体积混合所得溶液中:
2c(OH−)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32−)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列关于物质的检验说法不正确的是 ( )
A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子
B.观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后在用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察。
C.待检液加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定有NH4+ 存在
D.某溶液中滴入KSCN溶液后呈红色,说明该溶液中有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1的KI溶液: Na+、Ag+、NO 、SO
、SO
B.使甲基橙变红色的溶液:NH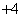 、Cu2+、ClO-、Cl-
、Cu2+、ClO-、Cl-
C.0.1 mol·L-1的KMnO4溶液:Na+、K+、Cl-、SO
D.遇苯酚变紫色的溶液:Na+、Mg2+、SO 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是
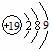 A.钾原子结构示意图: B.间羟基苯甲酸的结构简式:
A.钾原子结构示意图: B.间羟基苯甲酸的结构简式:
|
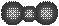
 D.Na2S的电子式:
D.Na2S的电子式: 查看答案和解析>>
科目:高中化学 来源: 题型:

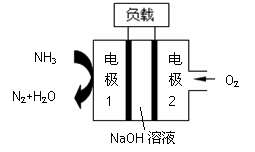
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电
池示意图如右,有关说法正确的是
A.电池工作时,Na+ 向负极移动
B.电子由电极2经外电路流向电极1
C.电池总反应为:4NH3+3O2=2N2+6H2O
D.电极2发生的电极反应为:O2+ 4H + + 4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白
作脱氯剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。

(1)用图5所示装置制取Na2S2O3,其中NaOH溶液的作用是 ▲ 。如将分液漏斗中的H2SO4
改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有 ▲ (填化学式)杂质生成。
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反
应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。
①利用KIO3、KI和HCl可配制标准碘溶液。写出配制时所发生反应的离子方程式: ▲ 。
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加 ▲ 作
指示剂,滴定终点的现象是 ▲ 。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则测量的Na2S2O3·5H2O的
质量分数会 ▲ (填“偏高”、“偏低”或“不变”)。
(3)本实验对Na2S的纯度要求较高,利用图6所示的装置可将工业级的Na2S提纯。已知Na2S
常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤依次为:
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图6所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待烧瓶中固体不再减少时,停止加热,将烧瓶取下;
④趁热过滤;
⑤ ▲ ;
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
按右图装置通入X气体,并在管P处点燃,实验结果是澄清石灰水变浑浊,则X、Y可能是 ( )。
A.H2和Fe2O3
B.CO和CuO
C.H2 和Na2CO3
和Na2CO3
D.CO和Na2CO3
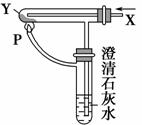
查看答案和解析>>
科目:高中化学 来源: 题型:
哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1molN2和3molH2,在一定条件下发生反应N2+3H2 2NH3 。下列有关说法正确的是:
2NH3 。下列有关说法正确的是:
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
C.达到化学平衡时,反应则停止进行
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,碳钢腐蚀与溶液pH的关系如下:
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2— |
下列说法不正确的是
A.在pH<4溶液中,碳钢主要发生析氢腐蚀
B.在pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e—=2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com