
【题目】将质量为1.15 g钠用刺了孔的铝箔包裹后放入水中,共收集到1.232 L(标准状况)气体。请回答下列问题:
(1)1.15 g钠与水反应,理论上生成气体的体积(标准状况)为__________ L 。
(2)Al和NaOH溶液反应也能生成H2,写出相应的化学方程式:_____________;
(3)若反应后溶液的体积为100 mL,则溶液中NaOH的物质的量浓度为多少?(写出计算过程)_______。
【答案】0.56 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 0.3mol/L
【解析】
(1)根据钠与水的关系式计算;
(2)根据反应物、生成物写出反应方程式并标出电子转移的方向和数目;
(3)氢气的总体积减去钠与水反应生成氢气的体积就是铝与氢氧化钠反应生成的氢气体积,根据铝与氢氧化钠反应生成的氢气体积计算消耗的氢氧化钠的物质的量,钠与水反应计算生成的氢氧化钠的物质的量减去铝与氢氧化钠反应的物质的量就是剩余的氢氧化钠的物质的量,根据浓度公式计算其浓度。
(1)设生成氢气的体积为x
2Na+2H2O=2NaOH+H2↑
46g 22.4L
1.15g x
![]() ,解得x=0.56L;
,解得x=0.56L;
(2)铝和氢氧化钠、水反应生成偏氯酸钠和氢气,在该反应中,Al失电子3e-,发生氧化反应,水中的H得电子2×e-,发生还原反应,转移电子数为最小公倍数是6,所以Al、NaAlO2的系数是2,氢气的系数是3,然后配平其它物质,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)Na与水反应方程式为2Na+2H2O=2NaOH+H2↑,1.15gNa的物质的量为n(Na)=![]() =0.05mol,由方程式关系可知反应产生的NaOH的物质的量为0.05mol,反应放出氢气的
=0.05mol,由方程式关系可知反应产生的NaOH的物质的量为0.05mol,反应放出氢气的
钠与水反应生成的氢氧化钠的物质的量为0.05mol,生成氢气的物质的量是0.025mol,其体积为V(H2)=0.025mol×22.4L/mol=0.56LL,则铝与氢氧化钠反应生成的氢气体积为1.232L-0.56L=0.672L,该氢气的物质的量为0.672L÷22.4L/mol=0.03mol根据Al与NaOH溶液反应的方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知与 Al反应的NaOH的物质的量为0.02mol,反应产生的NaAlO2的物质的量是0.02mol,所以剩余NaOH的物质的量为0.05mol-0.02mol=0.03mol,因此反应后溶液中氢氧化钠的物质的量浓度c=![]() =0.3mol/L。
=0.3mol/L。


科目:高中化学 来源: 题型:
【题目】山西老陈醋是中国四大名醋之一,已有 3000 余年的历史,素有“天下第一醋”的盛誉。
(1)山西人喜欢吃面食,面食为人体提供的营养物质主要是_______________,它对人体所起的作用是_________________。面食本身偏碱性,吃醋能增加胃液酸度,有助于食物的消化和吸收。
(2)炒菜时,加一点酒和醋能使菜味香可口,原因是(用方程式表示) ___________________,生成的有香味的物质是__________________(填名称)。
(3)碳酸氢钠是一种治疗胃酸过多的药物,若病人服用此药物的同时吃醋,会使药效大大降低,有关反应的化学方程式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g)+aQ(g),2 min后达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol·L-1,下列叙述错误的是( )
2Z(g)+aQ(g),2 min后达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol·L-1,下列叙述错误的是( )
A. a的值为2 B. 平衡时X的浓度为0.2 mol·L-1
C. Y的转化率为60% D. 反应速率v(Y)=0.3 mol·(L·min)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 氯气溶于水:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 钠与水反应:Na+2H2O===Na+2OH+H2↑
C. 氧化亚铁溶于稀硝酸:FeO+2H+===Fe2++H2 O
D. 向碳酸氢铵溶液中加入足量石灰水:NH4++HCO3-+Ca2++2OH-===CaCO3 ↓+NH3·H2O+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
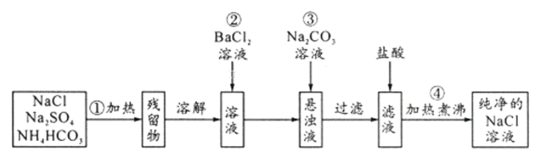
如果此方案正确,那么:
(1)操作①可选择________或________仪器。
(2)操作②是否可改为加硝酸钡溶液?为什么?________
(3)进行操作②后,如何判断SO42-已除尽,方法是__________________
(4)操作③的目的是__________,为什么不先过滤后加碳酸钠溶液?理由是___________。
(5)操作④的目的是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属桥墩腐蚀及防护是跨海建桥的重要课题。下列有关判断中正确的是


A. 用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀
B. ②中桥墩与外加电源正极连接能确保桥墩不被腐蚀
C. ③中采用了牺牲阳极的阴极保护法保护桥墩
D. ①②③中海水均是实现化学能与电能相互转化的电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A. 1 mol B和3 mol C
B. 2 mol A、1mol B和1 mol He(不参加反应)
C. 1 mol B和1 mol C
D. 2 mol A、3mol B和3 mol C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com