
下列关于反应能量的说法正确的是 ( )
A.Zn(s)+CuSO4 (aq)==ZnSO4 (aq) +Cu(s);△H=—216kJ·mol-1。则反应物总能量>生成物总能量
B.若一定条件下,A==B AH<O;说明A物质比B物质稳定
C.101kPa时,2H2(g)+O2(g)==2H2O(l);△H=—571.6kJ·mol-1,则H2的燃烧热为571. 6kJ·mol-l
D.H+(aq) +OH- (aq)=H2O(l);△H=-57. 3kJ.mol-1,含1mol NaOH的氢氧化钠溶液与含0. 5mol H2SO4的浓硫酸混合后放出57. 3kJ的热量
科目:高中化学 来源: 题型:
如图为刻蚀在玻璃上的精美的花纹图案,则该刻蚀过程中发生的主要化学反应为( )

A.CaCO3+2HCl===CaCl2+H2O+CO2↑
B.NaHCO3+HCl===NaCl+H2O+CO2↑
C.Si+4HF===SiF4↑+2H2↑
D.SiO2+4HF===SiF4↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
写出下列反应的化学方程式(有机物用结构简式):
(1)苯胺的浑浊液与盐酸反应;在反应得到的溶液中加入氢氧化钠溶液.
(2)1-溴丙烷与氢氧化钠的醇溶液共热;使所到的产物在催化剂TiCl3的作用下进行聚合.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:25℃时,电离常数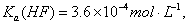 ,溶度积常数
,溶度积常数
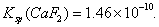 现向110.2 mol·L-1HF溶液中加入1L0.2 mo·L-l CaCl2溶液,则下列说法中正确的是 ( )
现向110.2 mol·L-1HF溶液中加入1L0.2 mo·L-l CaCl2溶液,则下列说法中正确的是 ( )
A.25℃时,0.1 mol.L-l HF溶液的pH=l
B.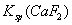 随温度和浓度的变化而变化
随温度和浓度的变化而变化
C.该体系中有CaF2沉淀产生
D.升高温度,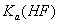 将变小
将变小
查看答案和解析>>
科目:高中化学 来源: 题型:
能源短缺是人类面临的重大问题。甲醇是一种可再生能源.具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
反应B:CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2
①下列条 件中,能说明反应A达到平衡状态的是 (2分)。
件中,能说明反应A达到平衡状态的是 (2分)。
A.生成甲醇的速率与生成水的速率相等
B.v(H2)/3=v(CH3OH)
C.恒容容器中,体系的压强不再改变
D.恒容容器中,混合气体密度不再发生改变
②在一定的压强下,将CO与H2的混合气体在催化剂作用下能自发反应生 成甲醇,则
成甲醇,则
△H2 0,△S 0(填“>”、“=”或“<”)(每空1分)。
③对于反应B,若容器容积不变,下列措施可增加甲醇产率的是 (2分)。
A.升高温度
B.将CH。OH(g)从体系中分离
C.充入He,使体系总压强增大
D.按原比例再充入CO和H。
④某温度下,将2mol CO和6mol H2,充人2L的密闭容器中,充分反应,达到平衡后,测得c(CO) =0.2 mol·L—1,则CO的转化率为 (2分),则该温度下该反应的平衡常数为 (2分)。
(2)已知在常温常压下:
①2CH3OH(I)十3O2(g) CO2(g)+4H2O(g) △H:-1275.6 kJ·mol—1
②2CO(g)+O2 (g)===2CO2 (g) △H= -566.0 kJ·mol—1
③H2O(g)===H2O(I) △H=- 44.0 kJ.mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式 (2分).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A、淀粉和纤维素的通式都是(C6H10O5)n,是同分异构体
B、油脂属于酯类
C、油脂的氢化又叫油脂的硬化
D、葡萄糖能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
 CO(g) +H2O(g)
CO(g) +H2O(g)  CO2(g) +H2 (g) △H<0。
CO2(g) +H2 (g) △H<0。
(1)CO和H2O浓度变化如右图,则在该温度下,该反应
的平衡常数K= 。
0~4min的平均反应速率v(CO)=_____mol·L-1·min-1。若降低温度,该反应的K值将 ,该反应的化学反应速率将 (填“增大”“减小”或“不变”)。
(2)在相同容器中发生上述反应,当温度高于850℃时,
容器内各物质的浓度变化如下表。
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中3min~4min之间反应处于_________状态; c 1数值_________0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是_________
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com