
| A、100mL pH=3的盐酸和醋酸溶液,与足量锌反应时,起始时产生氢气的速率醋酸快 |
| B、100 mL 1 mol?L-1的盐酸和50 mL 2 mol?L-1的盐酸分别与足量的锌反应,两者放出氢气的速率和质量均相等 |
| C、100 mL pH=3的盐酸和醋酸溶液,与足量锌反应后,所得氢气的质量醋酸多 |
| D、100 mL 0.1mol?L-1的硫酸和盐酸溶液,与足量锌反应后,前者放出氢气的质量是后者放出氢气质量的2倍 |


科目:高中化学 来源: 题型:
| A、①③④⑤⑥ | B、①⑤⑥ |
| C、①④⑤ | D、① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②①③⑧⑦⑥⑤④ |
| B、①②③⑧⑦⑥⑤④ |
| C、②①③⑦⑧⑥⑤④ |
| D、②①③⑧⑦⑥④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、Y、Z |
| B、X、Z、Y |
| C、Y、Z、X |
| D、Z、X、Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na和O2 |
| B、NaOH和CO2 |
| C、NaAlO2和盐酸 |
| D、AlCl3和氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、NaHCO3溶液中,一定有c(Na+)=c(HCO3-)+c(CO32-) |
| B、1 mol?L-1HCN溶液与1mol?L-1NaOH溶液等体积混合后,测得所得溶液显酸性 |
| C、等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(NaHCO3)>pH(CH3COONa) |
| D、1 mol?L-1醋酸溶液加水稀释,所有离子浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
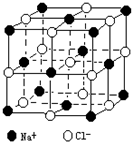 随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高.现有一种简单可行的测定方法,具体步骤为:
随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高.现有一种简单可行的测定方法,具体步骤为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com