
【题目】已知:将Cl2通人适量KOH溶液中,产物中可能有KCl、KClO、KClO3,且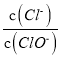 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
A. 若某温度下,反应后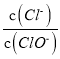 =3,则溶液中
=3,则溶液中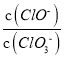 =5:2
=5:2
B. 参加反应的氯气的物质的量等于0.5amol
C. 改变温度,反应中转移电子的物质的量ne-的范围: ![]()
D. 改变温度,产物中KCl的最大理论产量为![]() mol
mol
【答案】D
【解析】A.设n(ClO-)=1mol,反应后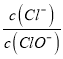 =3,则n(Cl-)=3mol,电子转移守恒,5×n(ClO3-)+1×n(ClO-)=1×n(Cl-),即:5×n(ClO3-)+1×1mol=1×3mol,解得:n(ClO3-)=
=3,则n(Cl-)=3mol,电子转移守恒,5×n(ClO3-)+1×n(ClO-)=1×n(Cl-),即:5×n(ClO3-)+1×1mol=1×3mol,解得:n(ClO3-)=![]() mol,故溶液中
mol,故溶液中 =
=![]() ,故A正确;B.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH),故参加反应的氯气的物质的量为:n(Cl2)=
,故A正确;B.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH),故参加反应的氯气的物质的量为:n(Cl2)= ![]() n(KOH)=0.5a mol,故B正确;C.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n(KClO3)=
n(KOH)=0.5a mol,故B正确;C.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n(KClO3)= ![]() n(KOH)=
n(KOH)= ![]() a mol,转移电子最大物质的量为:
a mol,转移电子最大物质的量为: ![]() a mol×5=
a mol×5=![]() a mol,氧化产物只有KClO时,转移电子最少,根据电子转移守恒n(KCl)=n(KClO),根据钾离子守恒:n(KCl)+n(KClO)=n(KOH),故:n(KClO)=
a mol,氧化产物只有KClO时,转移电子最少,根据电子转移守恒n(KCl)=n(KClO),根据钾离子守恒:n(KCl)+n(KClO)=n(KOH),故:n(KClO)= ![]() n(KOH)=
n(KOH)= ![]() a mol,转移电子最小物质的量=
a mol,转移电子最小物质的量=![]() a mol×1=
a mol×1=![]() a mol,则反应中转移电子的物质的量ne的范围为:
a mol,则反应中转移电子的物质的量ne的范围为: ![]() a mol≤ne≤
a mol≤ne≤![]() a mol,故C正确;D.氧化产物只有KClO3时,转移电子最多,则生成的KCl的物质的量最大,由C中计算可知:n最大(KClO3)=
a mol,故C正确;D.氧化产物只有KClO3时,转移电子最多,则生成的KCl的物质的量最大,由C中计算可知:n最大(KClO3)= ![]() n(KOH)=
n(KOH)= ![]() a mol,则n最大(KCl)=
a mol,则n最大(KCl)= ![]() n(KOH)=
n(KOH)= ![]() a mol,故D错误;故选D。
a mol,故D错误;故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某澄清透明溶液中只可能含有①Al3+;②Mg2+;③Fe3+;④Fe2+;⑤H+;⑥CO32﹣;⑦NO3﹣中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是( ) 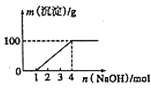
A.③⑤⑦
B.②③⑤⑦
C.①②③⑥⑦
D.①②③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份100mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸体积之间的关系如图所示。下列说法正确的是
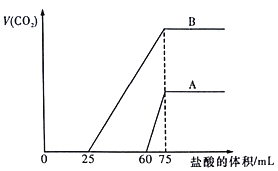
A. B曲线中消耗盐酸0<V(HCl)<25mL时发生的离子反应为: OH-+H+=H2O,H++CO32-=HCO3-
B. 原NaOH溶液的物质的量浓度为0.75mol/L
C. B曲线最终产生的CO2体积(标准状况下)为112mL
D. 加盐酸之前A溶液中的溶质是碳酸钠和碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如右图所示。下列分析不正确的是( )

A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH–
C. c点,两溶液中含有相同量的OH–
D. a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)3C(g)+2D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高.
物质 | A | B | C | D |
起始投料/mol | 2 | 2 | 3 | 0 |
该反应的平衡常数表达式为K= . 升高温度,平衡常数将(填“增大”“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面两种方法可以制得白色的Fe(OH)2沉淀:
【方法一】用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应来制备。
实验室用硫酸亚铁晶体配制上述FeSO4溶液时,一般需加入铁粉和稀硫酸,加入铁粉的目的是_____________。
【方法二】在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂来制备。

(1)实验开始时,止水夹e是______(填“打开”或“关闭”)的。
(2)如何检验装置内空气已经排尽?________________。
(3)排尽装置内空气后,为了制得白色Fe(OH)2沉淀,操作步骤是________。
(4)开启活塞f放掉约2/3液体,此时裝置B中试剂瓶中发生的化学反应方程式为________。
(5)下列各图示中________(填序号)能较长时间看到Fe(OH)2白色沉淀。
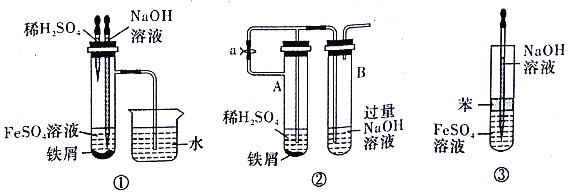
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com