
 25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:
25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:分析 (1)P点为硫酸氢铵溶液,硫酸氢铵为强电解质,在溶液中完全电离出氢离子、铵根离子和硫酸根离子,溶液呈酸性;
(2)M点溶质为硫酸铵和硫酸钠,铵根离子水解促进了水的电离,而Q溶质为硫酸钠和一水合氨,溶液呈碱性,氨水中氢氧根离子抑制了水的电离;
(3)a.M点溶质为等浓度的硫酸钠和硫酸铵,铵根离子部分水解;
b.N点溶液呈中性,c(H+)=c(OH-),结合电荷守恒判断;
c.Q点溶质为等浓度的硫酸钠和一水合氨,结合物料守恒判断.
解答 解:(1)P点氢氧化钠溶液体积为0,此时为NH4HSO4溶液,NH4HSO4为强电解质,在溶液中完全电离:NH4HSO4=NH4++H++SO42- (或 HSO4-=H++SO42-),溶液呈酸性,所以此时溶液的pH<7,
故答案为:NH4HSO4=NH4++H++SO42- (或 HSO4-=H++SO42-);
(2)根据图示可知,M点加入10mLNaOH溶液,此时二者恰好反应生成硫酸钠和硫酸铵,铵根离子发生水解,促进了水的电离;Q点加入20mLNaOH溶液,此时溶质为硫酸钠和NH3•H2O,氨水电离出的氢氧根离子抑制了水的电离,所以水的电离程度较大的为M点,
故答案为:M;
(3)a.M点溶质为等浓度的硫酸钠和硫酸铵,由于铵根离子部分水解,导致铵根离子浓度减小,则c(Na+)>c(NH4+),故a正确;
b.N点溶液呈中性,则c(H+)=c(OH-),结合电荷守恒可知:c(NH4+)+c(Na+)=2c(SO42-),故b正确;
c.Q点溶质为等浓度的硫酸钠和一水合氨,结合物料守恒可知:2c(NH4+)+2c(NH3•H2O)=c(Na+),故c错误;
故答案为:ab.
点评 本题考查溶液酸碱性与溶液pH的关系、离子浓度大小比较,题目难度中等,明确图象曲线各点对应溶质组成为解答关键,注意掌握电荷守恒、物料守恒、盐的水解原理的含义及应用,试题培养了学生的分析、理解能力及灵活应用能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中氮元素被氧化,氯元素被还原 | |
| B. | 还原性 NH4+>Cl- | |
| C. | 反应中每生成1 mol N2,转移6 mol电子 | |
| D. | 经此法处理过的废水可以直接排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
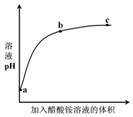 室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵
室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵| A. | a点,pH=2 | |
| B. | b点,c(CH3COO-)>c(NH4+) | |
| C. | c点,pH可能大于7 | |
| D. | ac段,溶液pH增大是CH3COOH?H++CH3COO-逆向移动的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳的结构式:O=C=O | B. | 氯化氢的电子式: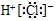 | ||
| C. | ${\;}_{1}^{3}$H的原子结构示意图: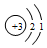 | D. | 水的电离方程式:H2O=H++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
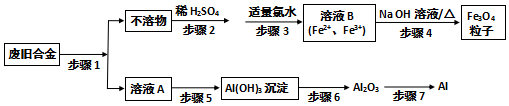
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| A | FeCl2 溶液 | FeCl3 | KSCN 溶液 |
| B | H2 | SO2 | NaOH 溶液 |
| C | Fe2(SO4)3溶液 | FeSO4 | Cl2 |
| D | SiO2 | Fe2O3 | NaOH 溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com