
| 1 |
| 2 |
| 1 |
| 2 |
| A.△H2-△H1 | B.△H2+△H1 | C.△H1-△H2 | D.-△H1-△H2 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 1 |
| 2 |
| A.+131.3kJ?mol-1 | B.-131.3kJ?mol-1 |
| C.+373.1kJ?mol-1 | D.-373.1kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 金属离子 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 3 | 3:1 | 实验②和④探究______ 实验②和______探究反应时间对产率的影响 |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | ______ | |
| ④ | 398 | 4 | 4:1 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1mol/L1L的稀HCl溶液与1mol/L1L的稀NaOH溶液 |
| B.1mol/L1L的稀H2SO4溶液与1mol/L2L的稀NaOH溶液 |
| C.1mol/L2L的稀HCl溶液与1mol/L1L的稀Ba(OH)2溶液 |
| D.1mol/L1L的稀H2SO4溶液与1mol/L1L的稀Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.01 mol/L盐酸 | B.0.01 mol/L Na2CO3溶液 |
| C.pH =" 4" NaHSO3溶液 | D.pH =11氨水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| n(SO3²﹣):n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
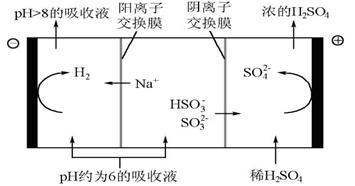
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com