
| �������� | Fe3+ | Fe2+ | Cu2+ |
| �������↑ʼ����ʱ��pH | 1.9 | 7.0 | 4.7 |
| ����������ȫ����ʱ��pH | 3.2 | 9.0 | 6.7 |



 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A������һ���ķ����ԣ���ijһ����������ɸߵ����Է����� |
| B�������������������Է�����һ����������ϵ�����ı���ͻή�� |
| C����һ�������ȣ��Է��������ǵ���������ڷ�ƽ��״̬ |
| D����һ�������ݲ����Է��仯�ܷ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0molS02 | B��2molS03 | C��1mol02 | D��1molSO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
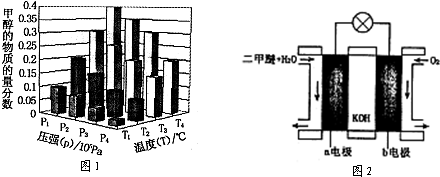
| ���� |
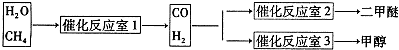
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
 HCO3-+H+��ƽ�ⳣ��K1=______������֪��10-5.60=2.5��10-6��
HCO3-+H+��ƽ�ⳣ��K1=______������֪��10-5.60=2.5��10-6���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| 1 |
| 2 |
| 1 |
| 2 |
| A����H2-��H1 | B����H2+��H1 | C����H1-��H2 | D��-��H1-��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
| ���� |
| 180�� |
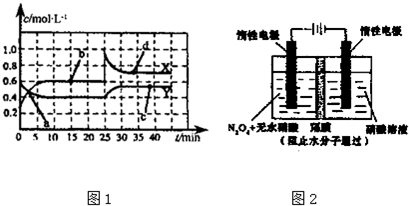
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| A��100mL����ˮ�У� | B��100mL 0.2 mol��L��1AgNO3��Һ�У� |
| C��100 mL 0.1 mol��L��1AlCl3��Һ�У� | D��100mL 0.1 mol��L��1������Һ�С� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
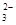 ��+c��HCO
��+c��HCO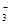 ��]
��]| A���٢� | B���ڢ� | C���٢� | D���ڢ� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com