
【题目】下列关于物质的分类或性质描述不正确的是( )
A.NaClO是盐,具有强氧化性
B.氯气能使湿润的红色布条褪色,是因为氯气具有漂白性
C.氯气能使湿润的红色布条褪色,是因为HClO具有漂白性
D.干燥的氯气不具有漂白性
科目:高中化学 来源: 题型:
【题目】最简式相同,但既不是同系物,又不是同分异构体的是
①辛烯和3-甲基-1-丁烯
②苯和乙炔
③1-氯丙烷和2—氯丙烷
④甲基环己烷和乙烯
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的前四周期元素,元素W是宇宙中最丰富的元素,元素X的原子最外层电子数是其内层的3倍,元素Z的基态原子核外电子有24种运动状态,Y、X、Z不在同一周期,且Y原子核外p电子比s电子多5个。
(1)Z基态原子的核外电子排布式为__________。
(2)Z的氧化物是石油化工中重要的催化剂之一,如催化异丙苯(![]() )裂化生成苯和丙烯。
)裂化生成苯和丙烯。
①1mol丙烯分子中含有σ键与π键数目之比为_______。
②苯分子中碳原子轨道的杂化类型为__________。
③Z的一种氧化物ZO5中,Z的化合价为+6,则其中过氧键的数目为_______个。
(3)W、X、Y三种元素的电负性由小到大顺序为__________。(请用元素符号回答)
(4)ZY3熔点为1152℃,熔融状态下能够导电,据此可判断ZY3晶体属于__________(填晶体类型)。
(5)ZX2晶体的晶胞结构如图,每个Z原子周围最近的X 原子数目为__________。若该化合物的相对分子质量为M,晶胞边长为acm,阿伏加德罗常数为NA,则该晶体的密度为_________g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL 18 mol·L-1的H2SO4溶液中加入适量的铜片并加热。充分反应后,被还原的H2SO4的物质的量( )
A. 小于0.45 mol B. 等于0.45 mol
C. 在0.45~0.90 mol之间 D. 大于0.45 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸(HCOOH)是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。
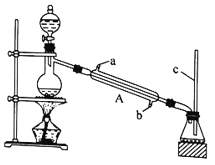
I.甲酸能与醇发生酯化反应
该兴趣小组用如上图所示装置进行甲酸(HCOOH)与甲醇(CH3OH)的酯化反应实验:
有关物质的性质如下:
沸点/℃ | 密度(g·cm-3) | 水中溶解性 | |
甲醇 | 64.5 | 0.79 | 易溶 |
甲酸 | 100.7 | 1.22 | 易溶 |
甲酸甲酯 | 31.5 | 0.98 | 易溶 |
(1)装置中,仪器A的名称是_________________,长玻璃管c的作用是__________________________。
(2)甲酸和甲醇进行酯化反应的化学方程式为____________________________________________。
(3)要从锥形瓶内所得的混合物中提取甲酸甲酯,可采用的方法为__________________________________。
II.甲酸能脱水制取一氧化碳

(1)利用上图装置制备并收集CO气体,其正确的连接顺序为a→__________(按气流方向从左到右,用小写字母表示)。
(2)装置B的作用是__________________________________。
(3)一定条件下,CO能与NaOH固体发生反应:CO+NaOH ![]() HCOONa。
HCOONa。
①为了证明“CO与NaOH固体发生了反应”,设计下列定性实验方案:取固体产物,配成溶液,___________。
②测定产物中甲酸钠(HCOONa)的纯度:准确称取固体产物8,0g配制成100mL溶液,量取20.00mL该溶液于锥形瓶中,再加入___________作指示剂,用1.5mol/L的盐酸标准溶液滴定剩余的NaOH,平行滴定三次,平均消耗盐酸的体积为5.05mL,则产物中甲酸钠的质量分数为_______(计算结果精确到0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】描述弱电解质电离情况可以用电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10﹣5 |
HNO2 | 4.6×10﹣4 |
HCN | 5×10﹣10 |
HClO | 3×10﹣8 |
NH3H2O | 1.8×10﹣5 |
表2
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10﹣10 |
BaCO3 | 2.6×10﹣9 |
CaSO4 | 7×10﹣5 |
CaCO3 | 5×10﹣9 |
请回答下列问题:
(1)表1所给的四种酸中,酸性最弱的是_____(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是___(填字母序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈_____(选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系为_____。
(3)物质的量之比为1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的顺序为_____。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01molL﹣1,则溶液中CO32-物质的量浓度最少应为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用指定材料做电极来电解一定浓度的溶液甲,然后加入物质乙能使溶液恢复为甲溶液原来的浓度,则合适的组是:
阳极 | 阴极 | 溶液甲 | 物质乙 | |
A. | Pt | Pt | NaOH | NaOH固体 |
B. | Pt | Pt | H2SO4 | H2O |
C. | C | Fe | NaCl | 盐酸 |
D. | 粗铜 | 精铜 | CuSO4 | Cu(OH)2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.01mol某气体的质量为0.44g,该气体的摩尔质量为_______;在标准状况下,该气体的密度是_______
(2)0.3 mol氨气和0.4 mol二氧化碳的质量________(填“相等”或“不相等”,下同),所含分子数________,所含原子数________.
(3) 质量都是50 g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是________,在相同温度和相同压强条件下,体积最大的是________,体积最小的是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两种有机物(结构简式如下图),下列说法不正确的是
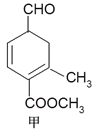
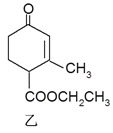
A. 二者与溴的CCl4溶液发生加成反应,消耗溴的物质的量分别为2mol、1mol
B. 甲、乙互为同分异构体
C. 1mol甲与H2在一定条件下反应,最多消耗3mol H2
D. 等物质的量的甲、乙分别与NaOH溶液反应,消耗NaOH的量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com