
(1)对于![]() ,按下列要求各举一例:
,按下列要求各举一例:
①Z、n、b相同而A不同___________。
②A、n、b相同而Z不同___________。
③A、Z、b相同而n不同___________。
④A、Z、n相同而b不同___________。
⑤A、Z相同而n、b不同___________。
(2)已知An+1、B(n+1)+、Cn-、D(n-1)-四种离子具有相同的电子层结构,则
①四种元素原子序数由大到小的顺序为(用A>B>C>D的形式填写,下同):______________。
②四种元素原子半径由大到小的顺序为:______________。
③四种元素离子半径由大到小的顺序为:______________。
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:阅读理解
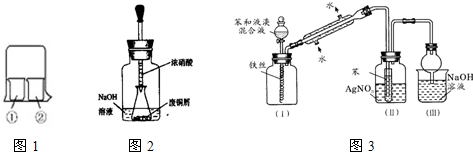
| 实验编号 | ①中的物质 | ②中的物质 |
| 1 | 淀粉碘化钾溶液 | 浓硝酸 |
| 2 | 酚酞溶液 | 浓硫酸 |
| 3 | 氯化铝溶液 | 浓氨水 |
| 4 | 湿润的红纸 | 饱和氯水 |
查看答案和解析>>
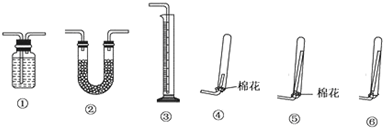
科目:高中化学 来源: 题型:阅读理解
 请你与小王同学一道完成下列问题的分析解答:
请你与小王同学一道完成下列问题的分析解答:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 压强MPa 转化率% 温度℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期中考试化学试卷(解析版) 题型:填空题
(11分)研究燃料的燃烧和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料:
已知:H2(g)+1/2O2(g)=H2O(g)
 H= −241.8kJ/mol
H= −241.8kJ/mol
C(s)+1/2O2(g)=CO(g)  H= −110.5kJ/mol
H= −110.5kJ/mol
写出焦炭与水蒸气反应制H2和CO的热化学方程式 。
(2)一定条件下,在密闭容器内,SO2被氧化成SO3的热化学方程式为:2SO2(g)+O2(g)  2SO3(g);
2SO3(g);
△H=−a kJ/mo1,在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A.4mo1 SO2和2mol O2 B.4mol SO2、2mo1 O2和2mol SO3
C.4mol SO2和4mo1 O2 D.6mo1 SO2和4mo1 O2
(3)汽车尾气中NOx和CO的生成及转化:
①已知气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g)
2NO(g)
 H>0
H>0
在一定温度下的定容密闭容器中,能说明此反应已达平衡的是
A.压强不变 B.混合气体平均相对分子质量不变
C.2v正(N2)=v逆(NO) D. N2的体积分数不再改变
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)
 H>0,
H>0,
简述该设想能否实现的依据 。
(4)燃料CO、H2在一定条件下可以相互转化:CO(g)+H2O(g)  CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为
。
CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为
。
查看答案和解析>>
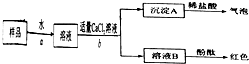
科目:高中化学 来源: 题型:
①实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用________的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。?
②除去H2中的CO2,可用________的方法除去。?
③除去乙醇中溶解的微量食盐可采用________的方法。?
④粗盐中含有不溶性的泥沙、可溶性的氯化钙、氯化镁及一些硫酸盐。要将粗盐提纯,可先将粗盐溶解,按一定的顺序加入沉淀剂,再________;然后将溶液调成中性并________就可以得到较为纯净的氯化钠。?
⑤除去氧化钙中的碳酸钙可用________的方法。?
(2)某样品中含有碳酸钠及少量的硫酸钠和氯化钠。某学生为了检验其成分,按照下图所示步骤进行实验,请将所加试剂及有关结论填写在相应的空格中。?

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com